La r�action acide-base
I. D�finitions acides, bases
I.1. D�finition historique
Mise en �vidence des acides et des bases gr�ce aux indicateurs (papier indicateur).
| Les acides ont une saveur aigre, rougissent le papier indicateur (tournesol) et r�agissent avec les bases pour former des sels. |
Les bases sont caustiques, ont une saveur amère et bleuissent le tournesol. |
|
Les d�finitions historiques se contentent de d�crire ce qu'il se passe, il s'agit de d�finitions op�rationnelles.
D�couverte : de l'acide en pleine nature. (suivez le lien) |
I.2. D�finitions d'Arrhenius
1.Un acide est une substance qui en solution aqueuse, libère un ou plusieurs protons (H+).
HCl ![]() H+ (aq) + Cl- (aq)
H+ (aq) + Cl- (aq)
H2SO4 ![]() 2 H+ (aq) + SO42- (aq)
2 H+ (aq) + SO42- (aq)
H3PO4 ![]() 3 H+ (aq) + PO43- (aq)
3 H+ (aq) + PO43- (aq)
2.Une base est une substance qui en solution aqueuse libère un ou plusieurs ions OH-
NaOH ![]() Na+
(aq) + OH- (aq)
Na+
(aq) + OH- (aq)
Ca(OH)2 ![]() Ca2+ (aq) + 2 OH- (aq)
Ca2+ (aq) + 2 OH- (aq)
3.La r�action Acide-base est une r�action où il y a formation d'eau (H2O) et de sel.
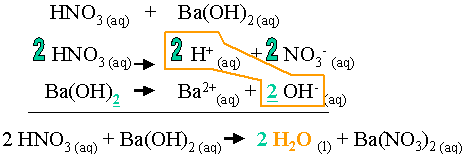
Une mole de Ba(OH)2 libère 2 moles de OH- en solution aqueuse. Une mole de HNO3 libère une mole de H+.
Pour neutraliser les 2 moles de OH- lib�r�es par Ba(OH)2, il faut deux moles de H+. Par cons�quent, il faut 2 moles de HNO3. Lors de la r�action, il se formera deux moles d'eau et une mole de sel.
I.3. Limites de la th�orie d'Arrhenius
|
H+ + H2O
|
|
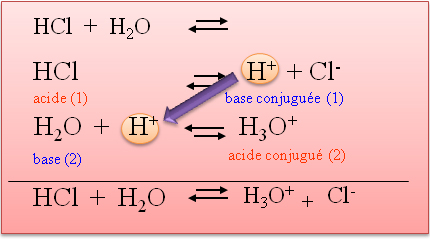
I.4. D�finition de Bronsted-Lowry
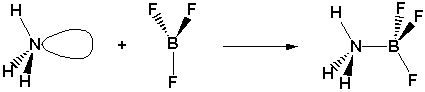
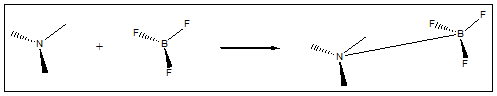
I.4.1. Exp�rience
 |
 |
|
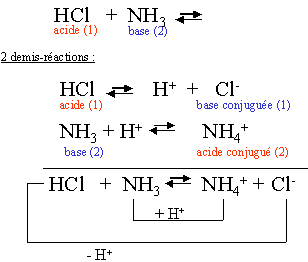
R�action entre un acide (HCl) et une base (NH3) en phase gazeuse. Formation d'une fum�e de NH4Cl. - http://www.chem.leeds.ac.uk/delights/photos/HCl+NH3/ |
|
I.4.2. D�finition d'un acide :
HCl ![]() H+ + Cl-
H+ + Cl-
H2SO4 ![]() H+ + HSO4- [couple : H2SO4/HSO4-]
H+ + HSO4- [couple : H2SO4/HSO4-]
HSO4-
![]() H+ + SO42- [ couple : HSO4-/SO42-]
H+ + SO42- [ couple : HSO4-/SO42-]

I.4.3. D�finition d'une base :
Une base est une substance (mol�cule ou ion) capable de capter (fixer) un H+ (proton).
NH3
+ H+ ![]() NH4+
NH4+
Na+ OH-
+ H+ ![]() H2O + Na+ (couple H2O/OH-)
H2O + Na+ (couple H2O/OH-)

I.4.4. La r�action acide base :
c'est un transfert de H+ (proton) entre deux couples Acides-bases.
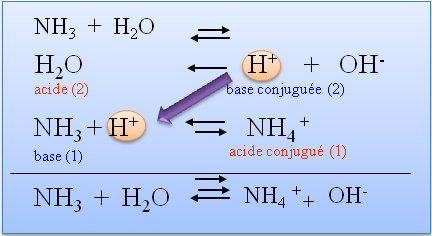
La th�orie de Bronsted-Lowry permet d'expliquer �galement la formation des espèces H3O+ et OH- dans un milieu selon que l'on rajoute à de l'eau un acide ou une base. Et permet donc d'expliquer ce qu'Arrhenius avait d�couvert. La th�orie d'Arrhenius est un cas particulier qui implique les couples H3O+/H2O (où l'eau est alors une base conjugu�e de l'acide) et H2O/OH- (où l'eau joue cette fois le r�le de l'acide).
Une substance qui, comme H2O, r�agit tant�t en acide, tant�t en base selon le partenaire est appel�e AMPHOLYTE.
e) D�finition de Lewis* :
La d�finition de Bronsted-Lowry, bien que r�solvant une partie des problèmes qui se posaient avec la th�orie d'Arrhenius, ne permet pas encore de caract�riser tous les acides et toutes les bases. En effet, dans le tableau p�riodique, certains �l�ments peuvent agir tant�t comme acide, tant�t comme base.
Voici quelques acides et bases de Lewis courants :
� Mark R. Leach 1999-2009 | http://www.meta-synthesis.com/
- Un acide est toute espèce qui peut accepter une paire d'�lectrons offerte par une autre espèce chimique lors d'une r�action.Un acide de Lewis est un accepteur d'�lectrons (�lectrophile)
Un acide de Lewis est caract�ris� par :
1) une fraction de charge positive sur l'atome central (due à la forte �lectron�gativit� des atomes li�s à ce centre)
2) la capacit� d'accepter une paire d'�lectron suppl�mentaire.Exemples : BF3 ,H+, AlH3
- Une base est toute espèce qui possède une paire d'�lectron non-liante et qui peut offrir une paire d'�lectrons à une autre espèce chimique lors d'une r�action. Une base de Lewis est donc un donneur d'�lectrons . (nucl�ophile)
Exemples : NH3 (1 paire non-liante), H2O (2 paires non-liantes), OH- (1 paire non-liante)
R�action de BF3 /!\ dans autre solvant que l'eau : (acide de Lewis, le Bore porte une charge partielle positive à cause de la très grande �lectron�gativit� des fluors qui captent vers eux les �lectrons du bore et NH3 est la base, car l'atome d'azote porte une paire d'�lectrons non-liants.
Remarques
- Le solvant joue souvent le r�le de l'acide ou de la base, ou à la fois de l'acide et de la base.
- L'eau et les solvants polaires peuvent agir soit comme base ou comme acide parce qu'ils ont des sites acides et basiques dans leur structure mol�culaire: L'eau peut agir comme base en offrant le partage d'une paire d'�lectrons libres que l'on y trouvait sur l'atome O , et comme acide par le biais d'�ventuelles liaisons hydrogènes..
- Le modèle propos� par Br�nsted appara�t ici comme un cas particulier de la th�orie de Lewis. En effet, H+ sera l'�lectrophile et OH- le nucl�ophile
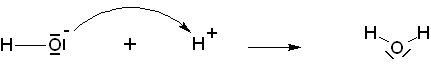
(*) Adapt� de Prof. Claude Piguet , Dr. Nadjet Ouali, Dr. Sylvain Koeller , Module 8 � La liaison chimique, Chimie G�n�rale On line, <http://chimge.epfl.ch/Fr/lc/1LC70.htm >, mai 2009
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - La r�action acide-base. La Chimie.net. http://www.lachimie.net | |
|
|