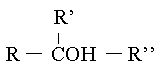Les
alcools
I. formule g�n�rale
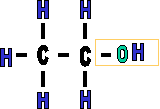 |
Cn H2n+1OH, valable uniquement pour les mol�cules ne poss�dant qu'une fonction alcool. Il existe aussi des mol�cules alc�nes sur lesquelles viennent se fixer des fonctions alcools. Dans ce cas la formule g�n�rale est Cn H2n-1OH. La fonction alcool prend toujours la place d'un hydrog�ne. |
Les alcools sont des mol�cules satur�es, car un m�me atome de carbone,
est entour� par 4 �l�ments distincts.
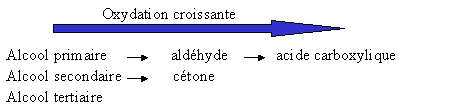
Les alcools se divisent encore en trois cat�gories : primaire, tertiaire et secondaire.
|
Formule g�n�rale |
nom |
caract�ristiques |
|
R-CH2-OH |
primaire | Un alcool est primaire si la fonction alcool
(-OH) se trouve en fin ou en d�but de cha�ne.
Butan-1-ol |
|
|
secondaire | Un alcool est secondaire si la fonction alcool
se trouve dans la cha�ne carbon�e.
Butan-2-ol ; butan-3-ol |
|
|
tertiaire | Un alcool est tertiaire si sur un m�me carbone
se trouvent une ramification et la fonction alcool.
M�thylpropan-2-ol |
L'oxydation (perte d'�lectrons) de ces compos�s donne d'autres compos�s aux fonctions diff�rentes :
II. G�om�trie de la fonction alcool
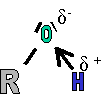 |
Le R repr�sente une cha�ne carbon�e alcane ou alc�ne sur laquelle vient se greffer une fonction alcool. La mol�cule est polaire, car la diff�rence d'�lectron�gativit� entre l'oxyg�ne et l'hydrog�ne fait appara�tre des charges partielles qui ne se compensent pas. |
La forme de la fonction alcool est donc un "V", cette forme et la
polarit� attribueront des propri�t�s sp�ciales
aux alcools.
III. Nomenclature
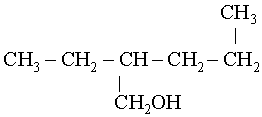 |
|
|
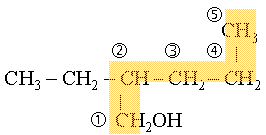 |
|
4. D�terminer et placer la/les ramification(s), puis citer le nom de la cha�ne
carbon�e en sp�cifiant de quel type de cha�ne carbon�e il s'agit alcane ou
alc�ne.
Ce
qui donne : 2-�thylpentan-1-ol
|
|
1. Lorsqu'il y a pr�sence d'un alc�ne, nommer comme suit : position
�ramification + pr�fixe alc�ne + position double liaison + �ne +
position fct alcool + OL 2. Lorsqu'il y a plusieurs alcools, proc�d�s comme pour les alc�nes,
citer les deux positions des groupements (-2,3-) et terminer par :
si 2 alcools : diol
Si 3 alcools : triol |
| exemple de nomenclature pour un alcool avec cha�ne carbon�e alc�ne : | |
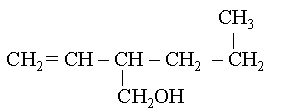 |
2-propylbut-3-�n-1-ol.
|
|
|
|
|
IV. Propri�t�s
IV.1. Temp�rature d'�bullition
Les alcools ont une temp�rature bien plus �lev�e que les alcanes ou
alc�nes de masses molaires semblables,
par exemple, l'�thane � une temp�rature d'�bullition de -89�C, alors que l'�thanol
a lui, une temp�rature d'�bullition de + 78�C.
Si la temp�rature d'�bullition est beaucoup plus importante, c'est que la mol�cule se comporte comme une mol�cule plus lourde que ce qu'elle est r�ellement.
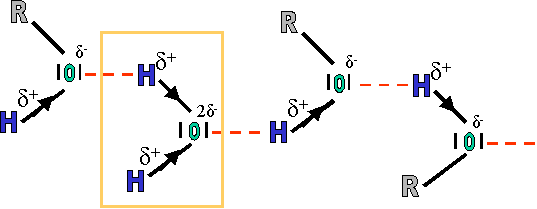
Cela est du � la pr�sence dans les mol�cules d'alcool du groupement OH. Dans ce groupement, la liaison O-H est fortement polaris�e vers l'atome O, �l�ment le plus �lectron�gatif
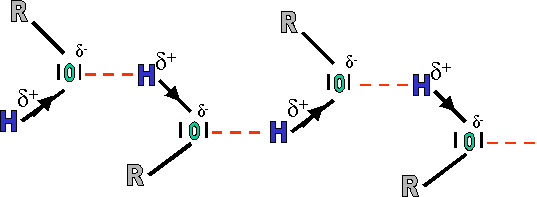
En fait, les oxyg�ne et hydrog�ne de chaque mol�cule sont attir�s l'un par l'autre (δ+ et δ- s'attirent). Il s'agit d'une action �lectrostatique entre l'oxyg�ne (δ-) d'une mol�cule et l'hydrog�ne (δ+) d'une seconde. Ces liaisons �lectrostatiques sont appel�es "ponts hydrog�ne". L'�nergie fournie devra donc d'une part briser ses ponts hydrog�ne et seulement ensuite pourra porter � �bullition la mol�cule. (2 fois plus de travail � effectuer, donc plus grand besoin en �nergie).
IV.2. Solubilit�
M�thanol, �thanol et propan-1-ol sont solubles dans l'eau en toutes proportions. C'est la pr�sence du groupement hydroxyle (OH) dans les mol�cules d'eau (H2O) et d'alcool, et la possibilit� de formation de ponts hydrog�ne entre les mol�cules d'eau et d'alcool qui explique cette grande solubilit�, pour autant que la cha�ne carbon�e ne soit pas trop longue !
IV.3. Combustion
Comme tous les compos�s organiques contenant du carbone, les alcools peuvent
r�aliser la combustion.
Alcool + O2
---> CO2 +
H2O + E (�
pond�rer)
|
|
Que signifie l'inscription en � sur une bouteille d'alcool ? (par exemple une bi�re � 5�) |
| Cela signifie que pour 100 mL de boisson, � une temp�rature de 15�C, La boisson renferme 1 mL d'alcool. Donc pour notre exemple, une bi�re contiendra 5 mL d'alcool pour 100mL de liquide � 15�C (La limite autoris�e est de 0.5g/litre de sang en Belgique). |
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - cours et ressources didactiques en chimie pour apprendre les savoirs disciplinaires, les savoir-faire et comp�tences de base des sciences chimiques. La Chimie.net. http://www.lachimie.net | |
|
|