L'�lectrolyse
Introduction
L'�lectrolyse est le ph�nom�ne inverse du ph�nom�ne de la pile. Il s'agit d'un ph�nom�ne non spontan�, forc�.
Il faut, gr�ce � un apport d'�nergie �lectrique ext�rieure, forcer la r�action chimique non spontan�e.
Lors d'un ph�nom�ne d'�lectrolyse, de l'�nergie �lectrique est transform�e en �nergie chimique. C'est une r�action qui fait intervenir des �lectrons.
Quelques applications
- purification de m�taux (qui sont sous forme de sels)
- plaquage des bijoux en plaqu� or
- purification du cuivre � haut niveau
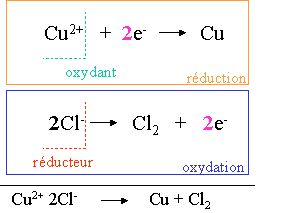
I. Electrolyse du CuCl2
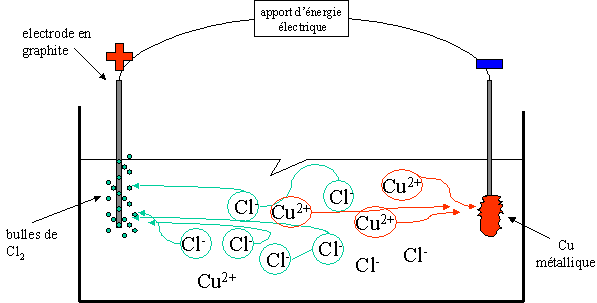
Le CuCl2 en solution (ions Cu2+ et 2 Cl-), est mis en pr�sence d'�lectrodes de graphite auxquelles sont appliqu�es une diff�rence de potentiel.
A la cathode, les ions Cu2+ sont r�duits en cuivre m�tallique qui se d�posent sur l'�lectrode.
A l'anode, les ions Cl- se transforment en Cl2 gazeux et du dichlore est d�gag�, il y a oxydation � l'anode qui est positive.
Les signes sont donc oppos�s � l'anode et � la cathode par-rapport au ph�nom�ne des piles !
II. Galvanoplastie (fabrication de l'acier galvanis�)
But : d�poser une fine couche m�tallique par �lectrolyse.
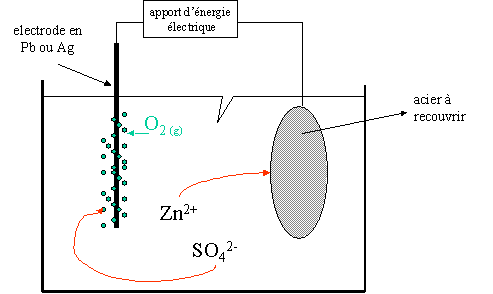
A l'�lectrode n�gative constitu�e par l'acier � recouvrir :
Zn2+ + 2e-
Zn
A l'�lectrode positive constitu�e de plomb ou d'argent :
2 H2O
O2 + 4e- + 4H+
L'eau r�agit dans cette r�action ! Les couples sont : Zn2+ / Zn et O2 / H2O.
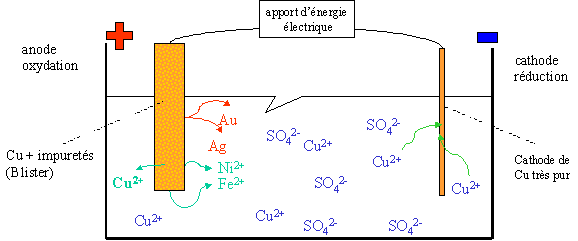
III. L'affinage du Cuivre 
Le cuivre tant utilis� dans la vie de tout le jour est produit � partir de minerais de cuivre extrait du sol et du recyclage. Dans le cycle de transformation du cuivre, diff�rentes m�thodes physiques et chimiques sont utilis�es dont l'�lectrolyse. Le cuivre doit �tre affin� jusqu'� l'obtention d'une puret� de 99,90%.
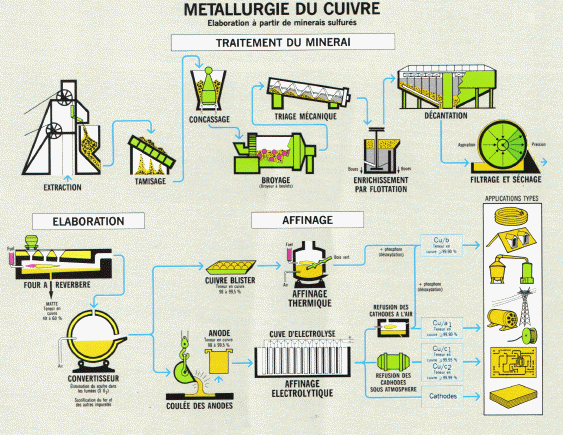
(c) illustrations : Centre d'information du cuivre, laitons et alliages, publication : le cuivre et ses alliages, m�tallurgie applications. http://www.cuivre.org
Int�ressons-nous � ce qu'il se passe au niveau de l'affinage �lectrolytique :
Les anodes contiennent d�j� de 95 � 99,5 % de cuivre mais aussi d'autres m�taux : fer, nickel, or, argent, ...
Les diff�rents couples qui entrent en compte dans cette r�action sont au niveau du blister, et par ordre de forces d�croissantes :
Au++/Au Ag+/Ag Cu++/Cu Ni++/Ni Fe++/Fe � l'anode : (oxydation)
1. Fe --> Fe2+ + 2e- 2. Ni --> Ni2+ + 2e- 3. Cu --> Cu2+ + 2e- Ag et Au tomberont tels quels dans la solution (forme m�tallique) � la cathode : (r�duction)
1. Cu2+ + 2e- --> Cu Ni2+ et Fe2+ ne r�agiraient avec la cathode que s'il n'y avait plus d'ions Cu2+ dans la solution, or la solution est toujours aliment�e par le blister (lingot) � l'anode et la solution de CuSO4 est r�guli�rement remplac�e.
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Electrolyse. La Chimie.net. http://www.lachimie.net | |
|
|