La valence
Les mol�cules sont des associations d'atomes. Ces associations ne se font pas n'importe comment, elles se font selon des r�gles pr�cises, dont la valence.
I. Electrolyse de l'eau
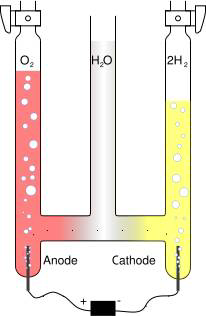
Gr�ce � une source de courant �lectrique, nous allons d�composer
des mol�cules d'eau en leurs constituants de base : De l'Oxyg�ne et de l'Hydrog�ne. Ces deux �l�ments se combinent alors entre eux pour former des associations plus stables ; les mol�cules de Dioxyg�ne (O2) et les mol�cules de Dihydrog�ne (H2).
Nous allons mettre en place un dispositif qui va s�parer l'eau en ces constituants, pour ce faire, nous utilisons une verrerie sp�ciale compos�e de tubes reli�s entre eux. Les deux tubes externes se composent � leur base d'une �lectrode, qui permet l'apport de courant � la solution et aux extr�mit�s d'un bouchon qui permet d'�vacuer les produits gazeux form�s.
Au d�but de l'exp�rience, on observe apr�s mit en route du courant, la formation de bulles aux �lectrodes. Ces bulles montent alors dans les tubes et l'eau diminue laissant la place aux gaz form�s.
On observe apr�s quelques minutes que les hauteurs d'eau dans les deux tubes sont diff�rentes. Dans le tube de droite l'eau est descendue deux fois plus bas que dans celui de gauche. Un gaz a donc �t� form� en quantit�
double
de l'autre.
On r�colte ensuite dans des �prouvettes un peu de gaz de chaque tube. Dans un cas, lorsque l'on approche une allumette de l'�prouvette, on entend un bruit de d�tonation et dans l'autre cas, lorsque l'on approche une allumette presque �teinte, on observe que celle-ci se rallume avec une belle flamme.

Sachant que :
- Une des propri�t�s du dihydrog�ne est d'�tre un gaz facilement inflammable, qui fait un bruit caract�ristique au contact du feu.
- Une des propri�t�s du dioxyg�ne est d'�tre un gaz comburant, ce qui signifie qu'il a la propri�t� de r�activer un feu.
L'on peut en conclure, que nous avons form� � partir de mol�cules d'eau, du dihydrog�ne et du dioxyg�ne. Si l'on observe les tubes d'o� proviennent les gaz, on remarque que l'on a form� 2 fois plus de dihydrog�ne que de dioxyg�ne.
Conclusion : Il y a dans les mol�cules d'eau 2 fois plus d'hydrog�ne que d'oxyg�ne : Cela correspond bien � la formule chimique : H2O, d�j� bien connue !
<>
Voyons maintenant, comment savoir quelles sont les quantit�s d��l�ments pr�sents au sein d'autres mol�cules. Pour cela nous aurons besoin du concept de valence.
II. La valence
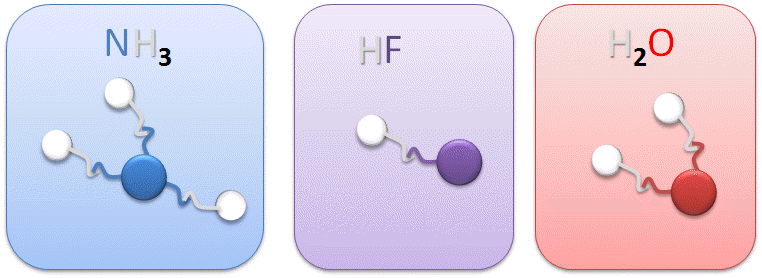
II.1. Quelques mol�cules courantes :
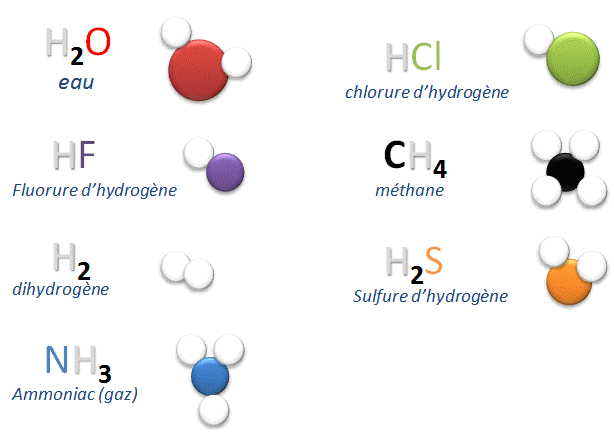
II.2. D�finition :
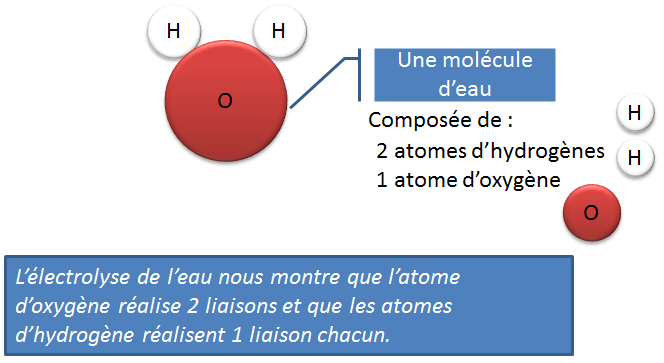
La valence d'un atome (�l�ment, ou groupement) est la capacit� de liaison de cet atome avec l'hydrog�ne. Autrement, dit, c'est le nombre d'atomes d'hydrog�ne maximal avec lequel un atome peut se lier.Par d�finition, l'atome d'hydrog�ne poss�de toujours 1 seul site de liaison (1 crochet). Pour les atomes courants, cette r�gle peut �tre �tendue aux autres atomes que l'hydrog�ne et donc donner le nombre de "crochets" que poss�de un atome pour se lier � d'autres et former des mol�cules.
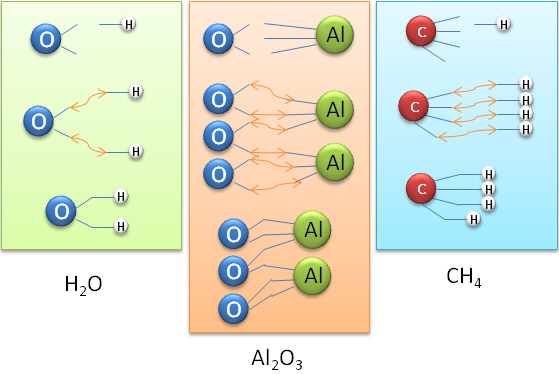
Dans le cas de la mol�cule d'eau (H2O); l'oxyg�ne poss�de deux sites de liaison (2 crochets) ! Il est donc possible de lier 2 atomes d'hydrog�ne � l'oxyg�ne, sa valence sera II.
II.3. Quelles sont les valences ?
Pour conna�tre la valence d'un �l�ment, il faut regarder le tableau de p�riodique. On aper�oit au passage que les symboles ne sont pas dispos�s n'importe comment mais dans des colonnes avec � leur t�te des chiffres romains. Les tableaux r�cents suivent la nouvelle recommandation et indique les groupes de 1 � 18. La notation en chiffre romain sera probablement bient�t abandonn�e.
Chaque colonne d�signe une famille ou plut�t un groupe. Voici pour chaque groupe la valence correspondante :
| Ia | IIa | IIIa | IVa | Va | VIa | VIIa | VIIIa | |
| groupe | 1 | 2 | 13 | 14 | 15 | 16 | 17 | 18 |
| valence associ�e | I | II | III | IV | III | II | I | 0 |
| valence | I | II | III | IV | III | II | I | - | ||||||||||
| n� colonne | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
1 | 1 H | 2 He | ||||||||||||||||
2 | 3 Li | 4 Be | 5 B | 6 C | 7 N | 8 O | 9 F | 10 Ne | ||||||||||
3 | 11 Na | 12 Mg |
| 13 Al | 14 Si | 15 P | 16 S | 17 Cl | 18 Ar | |||||||||
4 | 19 K | 20 Ca | 21 Sc | 22 Ti | 23 V | 24 Cr | 25 Mn | 26 Fe | 27 Co | 28 Ni | 29 Cu | 30
Zn | 31 Ga | 32 Ge | 33 As | 34 Se | 35 Br | 36 Kr |
5 | 37 Rb | 38 Sr | 39 Y | 40 Zr | 41 Nb | 42 Mo | 43 Tc | 44 Ru | 45 Rh | 46 Pd | 47 Ag | 48 Cd | 49 In | 50 Sn | 51 Sb | 52 Te |
53 I | 54 Xe |
6 | 55 Cs | 56 Ba | 57-71 | 72 Hf | 73 Ta | 74 W | 75 Re | 76 Os | 77 Ir | 78 Pt | 79 Au | 80 Hg | 81 Tl | 82 Pb | 83 Bi | 84 Po | 85 At | 86 Rn |
7
| 87 Fr | 88 Ra |
89-103 | 104
Rf | 105 Db | 106 Sg | 107 Bh | 108 Hs | 109 Mt | 110 Ds | 111 Rg | 112 Cn |
|
|
|
|
|
|
site de liaison 1 2 3 4 5 6 7 0
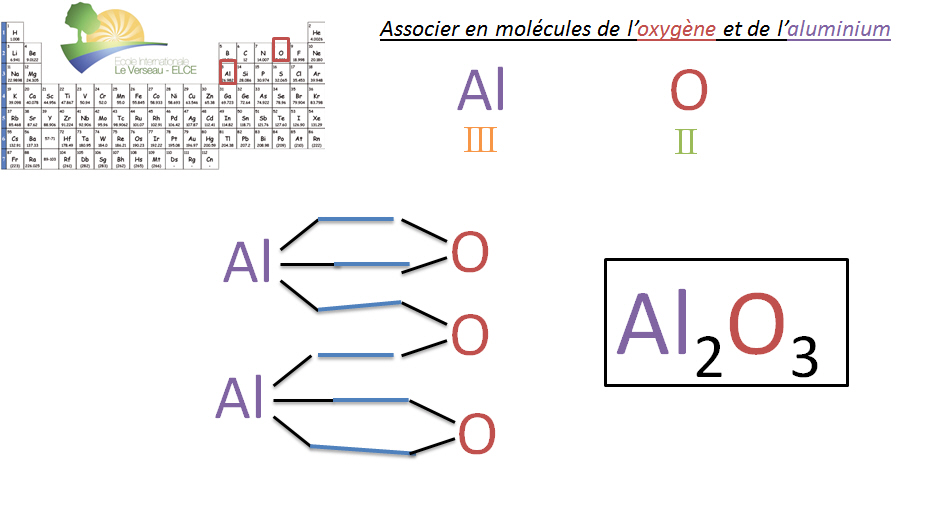
II.4. Construction de mol�cules avec l'aide des valences
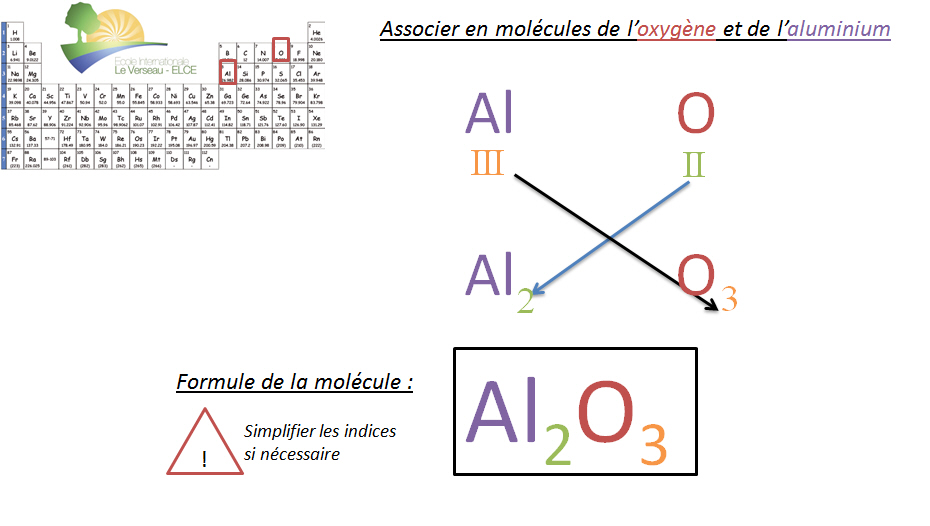
R�gle du CHIASME
Pour trouver les indices et donc le nombre d'atomes correct lors de la formation d'une mol�cule, il suffit d'inverser les valences des �l�ments. Cette inversion permet de donner l'indice de chaque atome. (!! Certains groupements d'atomes ont une valence particuli�re qui sera vue au th�me suivant).
Autres exemples :
NH3 : La valence de l'azote (N) est III, ce qui signifie que l'azote est capable de se lier � 3 hydrog�nes
Li OH : La valence du lithium (Li) est I, ce qui signifie que le lithium est capable de se lier � 1 hydrog�ne. La valence du groupement "OH", le groupement hydroxyde est �galement I. Ce qui signifie que l'on peu lier 1 hydrog�ne � ce groupement.
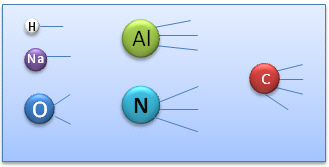
La m�thode des bras de valence
Cette m�thode consiste � repr�senter les diff�rents "bras" ou sites de liaisons que poss�de un atome selon sa valence. (Cette m�thode ne tient pas compte de l'organisation dans l'espace des sites).
Ainsi, l'on peut repr�senter les �l�ments avec leurs diff�rents sites de liaisons :
Il devient alors possible de construire des mol�cules en veillant � ce que les diff�rents sites des atomes soient li�s.
Une r�gle :
La valence des �l�ments s'indique toujours en chiffres ROMAINS
Remarque : La m�thode des valences constitue un moyen de former des mol�cules simples. Cette technique devrait toutefois rester r�serv�e � la formation de mol�cules avec l'hydrog�ne (si l'on veut rester fid�le � la d�finition). Il existe d'autres r�gles qui r�gissent la formation des mol�cules et la liaison d'atomes. Toutefois, cette r�gle nous permet de commencer la construction des premi�res mol�cules chimiques.
|
|
III. Valences particuli�res
Voici la valence de certains �l�ments des colonnes B (groupes 3 � 13), ils ont souvent plusieurs valences.
- Retenons ceux-ci :
| I | II | III | IV |
|
Ag |
|||
| Zn | |||
| Cu | Cu | ||
| Pb | Pb | ||
| Fe | Fe |
Il y a �galement des groupements pour lesquels une valence particuli�re a �t� attribu�e.
D�finition
Un groupement est un ensemble d'atome qui se comporte comme si il ne s'agissait que d'un seul atome. Un groupement poss�de sa propre valence.
| I | II | III | ||||||
| Forme ionique | Forme mol�culaire | nom | Forme ionique | Forme mol�culaire | nom | Forme ionique | Forme mol�culaire | nom |
| NH4+ | KNH4 | Ammonium |
CO32- |
K2CO3 | Carbonate | PO33- | K3PO3 | Phosphite |
| OH- | KOH | Hydroxyde | SO32- | K2SO3 | Sulfite | PO43- | K3PO4 | Phosphate |
| NO2- | KNO2 | Nitrite | SO42- | K2SO4 | Sulfate | |||
| NO3- | KNO3 | Nitrate | ||||||
| ClO- | KClO | Hypochlorite | ||||||
| ClO2- | KClO2 |
Chlorite |
||||||
| ClO3- | KClO3 | Chlorate | ||||||
| ClO4- | KClO4 | Perchlorate | ||||||
| MnO4- | KMnO4 | Permanganate | ||||||
|
| |||||||||
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - La valence. La Chimie.net. http://www.lachimie.net | |
|
|