Nombres quantiques et orbitales
De l'�quation de Schr�dinger l'on peut tirer les orbitales atomiques, qui sont des portions de l'espace (volume) dans lesquels il y a une grande probabilit� de trouver l'�lectron.
I. Les trois premiers nombres quantiques :
Chaque orbitale atomique est caract�ris�e par 3 nombres quantiques, le quatri�me ne concerne que l'�lectron.
| n | le nombre quantique principal | d�signe la couche | prend des valeurs d'entiers non-nuls : 1, 2, 3, 4,... |
|
|||
| l | nombre quantique secondaire ou azimutal | d�signe la sous-couche | prend des valeurs enti�res de 0 � (n-1). si n = 2 ; l = 0 ou 1 |
|
|||
forme des orbitales
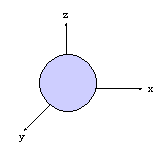
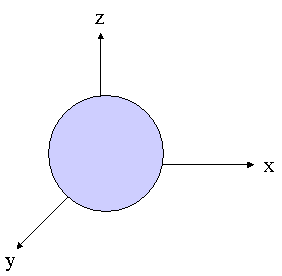
- orbitales s : sph�rique
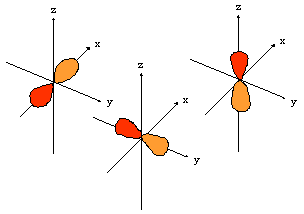
- orbitales p : plan nodal
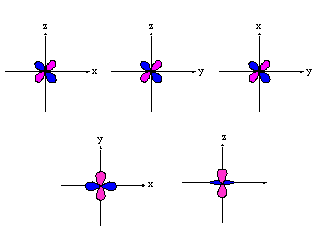
- orbitales d : 4 lobes avec 2 surfaces nodales
Il existe encore des orbitales f et g
| ml | nombre quantique magn�tique orbitalaire | caract�rise l'orientation dans l'espace. | prend des valeurs enti�res. |
|
|||
Ainsi chaque orbitale existe en versions diff�rentes (orientations dans l'espace diff�rentes) :
- orbitales s : sph�rique
- orbitales p : plan nodal
| orient� selon l'axe "px" | orient� selon l'axe "py" | orient� selon l'axe "pz" |
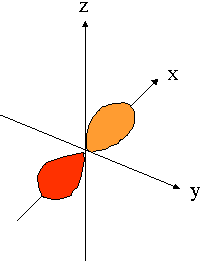 |
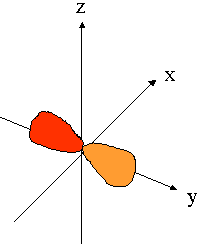 |
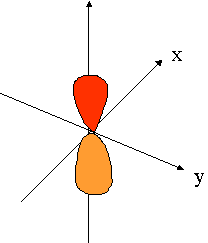 |
- orbitales d : 4 lobes avec 2 surfaces nodales
| dxz | dyz | dxy |
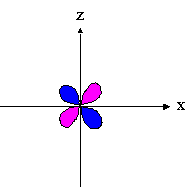 |
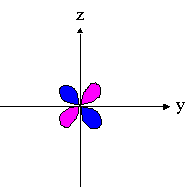 |
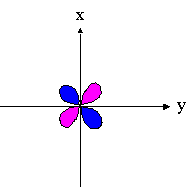 |
|
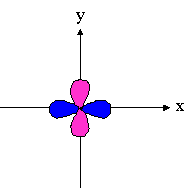
dx�-y� |
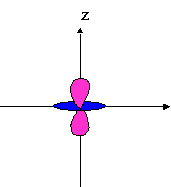
dz� |
|
 |
 |
II. Le spin de l'�lectron
Le 4i�me nombre quantique
L'�lectron est anim� d'un mouvement propre. Il tourne sur lui m�me comme une toupie. Ce mouvement de rotation de l'�lectron sur lui m�me engendre un moment magn�tique. (une charge en rotation engendre un moment magn�tique, or l'�lectron est une particule charg�e) Ce moment magn�tique se nomme le SPIN et est quantifi� : les valeurs de spin sont +1/2 ou -1/2.
![]()
![]()
Ce moment magn�tique constitue le quatri�me nombre quantique, le nombre quantique magn�tique de spin not� ms.
| ms | nombre quantique magn�tique de spin | d�signe l'orientation du spin | prend les valeurs +1/2 ou -1/2 uniquement |
|
|||
 En r�sum�
En r�sum�
chaque �lectron d'un atome peut �tre caract�ris� par 4 nombres quantiques : n, l, ml, ms. La combinaison de ces quatre nombres est unique pour un �lectron donn�. Par cons�quent, deux �lectrons d'un m�me atome diff�reront toujours d'au moins un nombre quantique. (principe de Pauli)
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Nombres quantiques et orbitales. La Chimie.net. http://www.lachimie.net | |
|
|


