R�action d'oxydor�duction : un transfert d'�lectrons
I. D�finition :
a. oxydation : r�action au cours de laquelle un �l�ment perd des �lectrons
Fe
Fe2+ + 2 e- (transformation du fer m�tallique en ions Fe2+)
b. r�duction : r�action au cours de laquelle un �l�ment gagne des �lectrons
Ag+ + 1 e
Ag (transformation des ions argent en argent m�tallique)
Historiquement, les termes "r�duction" et oxydation" d�signaient des r�actions au cours desquelles un ajout ou une perte d'oxyg�ne �tait observ�e, comme dans le cas de l'apparition de rouille (oxyde de fer).
II. Mise en �vidence des r�actions d'oxydor�duction :
| 1. Cu(s) + Ag+NO3-(aq)
|
Au temps t = 0 (gauche), le cuivre est de coloration brune orang�e brillant. Apr�s quelques minutes (droite), le cuivre m�tallique dispara�t, la solution bleuit et l'on peut constater l'apparition de paillettes brillantes. Il y a �galement apparition de bulles. |
| 2. Zn(s) + Cu2+SO42-(aq)
|
Au temps t = 0 (gauche), la solution est de couleur bleue. Apr�s quelques minutes (droite), les pastilles de zinc noircissent, la solution se d�colore et l'on constate l'apparition de paillettes de cuivre m�tallique en surface.
|
III. Mise en �quation et terminologie :
| 1. Cu(s) + Ag+NO3-(aq) |
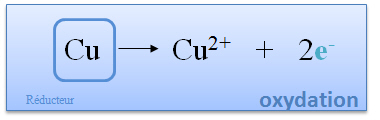 |
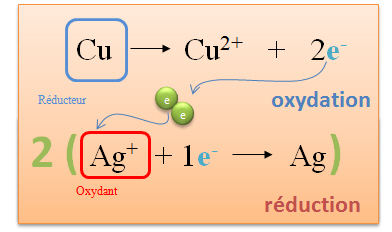
Le cuivre perd au cours de la r�action deux �lectrons. Cette r�action se nomme oxydation. Le cuivre est appel� r�ducteur, car c'est lui qui donne des �lectrons. |
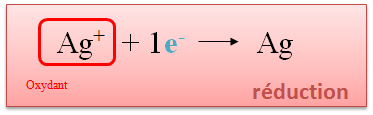 |
L'argent (sous forme d'ion) capte un �lectron lib�r� par le cuivre. L'argent est appel� oxydant. Cette r�action se nomme r�duction. |
| Deux �lectrons sont lib�r�s par le cuivre, or l'ion argent ne peut en capter qu'un seul. Pour �quilibrer cette r�action, il faut qu'un atome de cuivre r�agisse avec deux ions argent. |
|
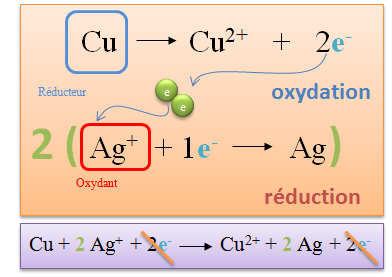 |
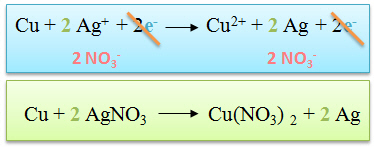
L'on �crit ensuite l'�quation bilan en
additionnant membre � membre de part et d'autre de la fl�che de
r�action.
L'on peut simplifier ce qui se trouve dans les deux membres. |
|
Durant ces �tapes nous avons volontairement
n�glig� les ions NO3-. On les r�int�gre dans
les proportions d�finies par la pond�ration dans les deux membres.
On �crit ensuite l'�quation sous forme mol�culaire et non plus ionique. |
| 2. Zn(s) + Cu2+SO42-(aq) |
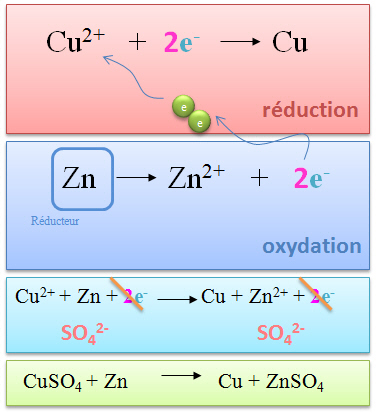 |
L'on obtient l'�quation ci-contre selon la
m�me m�thode. Ici, les �lectrons apparaissant en m�me nombre, l'�quation est d�j� pond�r�e. |
IV. Echelle d'oxydor�duction :
Les diff�rents couples d'oxydant/r�ducteur ont �t� class�s au sein de table. Cette classification se base sur une propri�t� mesur�e de fa�on empirique. Il s'agit du potentiel standard de r�duction.
Par convention, le potentiel standard de r�duction du couple H+/H2(g) a �t� fix� � 0 volt. Les autres couples sont class�s par-rapport � cette r�f�rence. Ces potentiels standards sont mesur�s selon des conditions particuli�res de pression : 1 bar, de concentration : 1 mole.L-1 et de temp�rature : 25�C.
Notation :
Le potentiel standard se note : E0
Nous classerons les couples du potentiel de r�duction le plus petit au potentiel de r�duction le plus grand.
Comment d�terminer dans quel sens aura lieu la r�action lorsque les �l�ments de deux couples sont mis en pr�sence ?
Afin de pouvoir d�terminer qui jouera le r�le de r�ducteur ou d'oxydant, il faut regarder dans la table des potentiels standards la position relative des deux couples.
Le couple qui poss�dera le potentiel de r�duction le plus �lev� sera r�duit et le couple au potentiel le plus petit sera oxyd�. Plus la diff�rence entre les potentiels de r�duction des couples sera �lev�e, plus la r�action sera favoris�e.
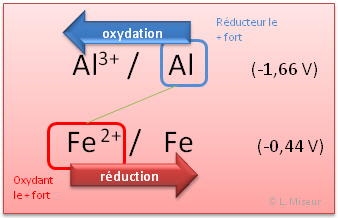
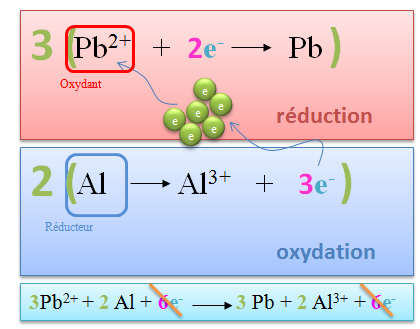
Quelle sera la r�action spontan�e entre les couples Pb2+/Pb et Al3+/Al ?
align="left">Rep�rons les positions relatives des couples au sein de la table des potentiels.
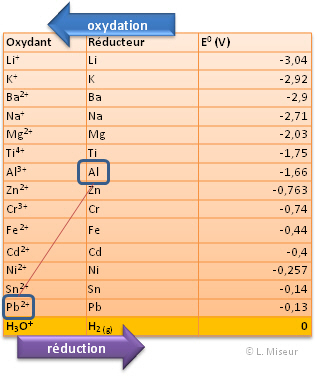
Il s'agit d'un extrait de tableau. Pour un tableau des couples redox plus complet, cliquer ici : Outils en ligne : tables kps, acides-bases, ..., puis sur l'onglet OX/RED.
Le couple le plus haut dans le tableau r�alisera spontan�ment l'oxydation. Le couple situ� le plus bas r�alisera spontan�ment la r�duction. Il faut donc regarder la position relative des �l�ments dans le tableau.
Dans notre exemple : Pb2+/Pb prend les e- (r�duction) et Al3+/Al c�de les e- (oxydation)
V. R�activit� avec l'eau :
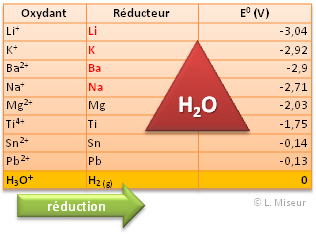
Nous avons vu que le couple H3O+/H2(g) a un potentiel de r�duction de 0 volt. Or, nous savons que l'eau pure contient une faible concentration d'ions H3O+. Lors de la mise en pr�sence de certains r�ducteurs, ceux-ci vont alors r�agir avec l'eau pour la r�duire en dihydrog�ne ! C'est le cas notamment des m�taux alcalins.
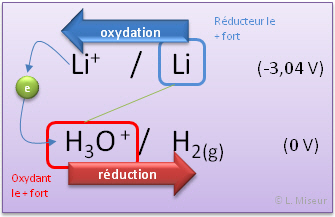
Prenons le cas du Lithium que l'on fait r�agir avec de l'eau
Le lithium, r�ducteur s'oxyde en ion lithium Li+ en lib�rant un �lectron. La r�action de r�duction de l'eau se d�roulera en m�me temps produisant un d�gagement de dihydrog�ne H2(g).
Ces r�actions avec l'eau peuvent �tre tr�s violentes. Voici une vid�o montrant la r�action des m�taux alcalins avec l'eau. (Li, Na, K, Rb, Cs)
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Oxydor�duction. La Chimie.net. http://www.lachimie.net | |
|
|