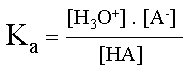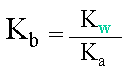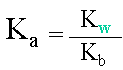Force des acides et des bases
I. Force des acides
La force d'un acide est la tendance qu'a celui-ci � c�der un H+ (proton) � l'eau. Elle se d�termine sous la forme d'une constante d'�quilibre particuli�re, Ka. L'acide peut c�der plus ou moins facilement son proton ; il est plus ou moins fort.
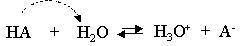
Si un acide est tr�s fort, il c�de tr�s facilement un proton, sa base conjugu�e sera alors tr�s faible (HCl et Cl-).
Dans un couple acide-base, si l'acide est fort, la base est faible et inversement
D�termination de la formule de la constante d'acidit� :
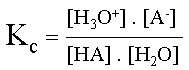
Ka = Kc . [ H2O]
Si Ka est "grand", la r�action est compl�te, l'acide sera fort.
Si Ka est "petit", la r�action est �quilibr�e, l'acide sera faible.
|
D�terminer la constante d'acidit� de l'acide benzo�que sachant que
|
|
|
II. Force des bases
La force d'une base est la tendance de celle-ci � capter un ion H+, un proton � l'eau.
D�termination de la formule de la constante Kb :
Kb = Kc . [ H2O ]
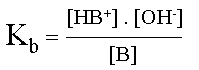
III. Relation entre Ka et Kb
D�monstration
| Soit le couple acido-basique HF/F- | ||||
| �criture de la demi-�quation pour l'acide, | ||||
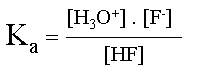 |
sa constante d'acidit� s'exprime sous forme d'une constante d'�quilibre. | |||
| �criture de la demi-�quation pour la base conjugu�e, | ||||
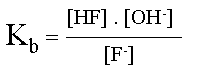 |
sa constante de basicit� s'exprime sous forme d'une constante d'�quilibre. | |||
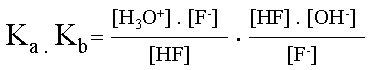 |
L'on �crit le produit de ses constantes obtenues. | |||
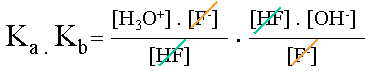 |
Simplifications. | |||
| Le produit de la constante d'acidit� et de basicit� d'un couple acido-basique est �gale au produit des concentrations en ions H3O+ et OH-. | ||||
| Ce produit d'ions est aussi �gal � la constante du produit ionique de l'eau Kw, qui vaut 10-14. | ||||
|
L'on peut ensuite exprimer la relation liant les constantes. |
Les constantes Ka et Kb �voluent entre des valeurs allant de 1010 � 10-20, ainsi comme pour le pH, il existe une fa�on de r�duire l'�chelle, pour pouvoir comparer plus facilement les valeurs entre elles ou pour faciliter les calculs. Il s'agit des notions de PKa et PKb.
PKa = - log Ka ; PKb = - log Kb
IV. Acides forts, faibles ou de forces nulles
Pour les compos�s dont la valeur de Ka est sup�rieure � 55,5, l'on peut consid�rer que la r�action est compl�te dans le sens de l'acide et impossible dans celui de la base. L'acide est fort et la base conjugu�e est de force nulle.
Pour les compos�s dont la valeur de Ka est comprise entre 55,5 et plus grande que 1,8.10-16, l'on peut consid�rer que la r�action aboutit � un �tat d'�quilibre. Ces compos�s sont des acides et bases faibles.
Pour les compos�s dont la valeur de Ka est �gale ou inf�rieure � 1,8.10-16, l'acide est de force nulle (r�action impossible) et la base forte (r�action compl�te).
V. R�le nivelant de l'eau ( ne concerne que les acides forts : Ka < 55,5!)
Des acides forts aux forces diff�rentes sont rendus de m�me niveau de force d'acide que H3O+ dans l'eau. H3O+ est l'acide le plus fort pouvant exister dans l'eau et OH- est la base la plus forte existant dans l'eau.
 |
l�gende :
|
 |
VI. Les sels
VI.1. Rappels : formule g�n�rale
|
formules |
dissociation dans l'eau |
cat�gories |
| MX | M+ (aq) + X- (aq) | sel binaire |
| MXO | M+ (aq) + XO- (aq) | sel tertiaire |
| RCOOM | M+ (aq) + RCOO- (aq) | sel organique |
M = un �l�ment m�tallique, X = un non-m�tal, R = une cha�ne carbon�e.
VI.2. pH d'un sel
Pour d�terminer le pH d'un sel, il faut d�composer celui-ci en ions. Lorsque la dissociation est faite, regarder dans quelle cat�gorie se classent ces ions (acide forts, faibles, de force nulle, bases, ...). Ce classement permettra de voir de quel �l�ment d�pend l'acidit� et donc le pH. Le pH d�pend toujours de la substance la plus "forte".
VI.2.1. Sel neutre : pH = 7
[K+] et [Cl-] n'influence pas le milieu. Le pH est d�termin� par l'eau. Or, le pH de l'eau vaut 7.
VI.2.2. Sel acide : pH < 7
La base Br - n'ayant aucune force, c'est l'acide NH4+ qui donnera le caract�re acide du milieu
VI.2.3. Sel basique : pH > 7
L'acide Na+ n'ayant aucune force, c'est la base CO32- qui donne le caract�re basique du milieu.
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Force des acides. La Chimie.net. http://www.lachimie.net | |
|
|