D�placement de l'�quilibre chimique
I. Principe de Le Chatelier
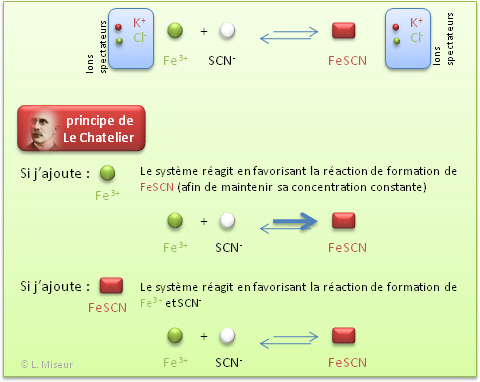
Si on impose une modification (concentration, temp�rature, pression) à un système chimique en �quilibre, le système �volue vers un nouvel �tat d'�quilibre de manière à contrecarrer la modification introduite.
Si on chauffe un m�lange dont la r�action directe est exothermique, le système en trop grande quantit� de chaleur l'�vacuera en r�alisant une r�action endothermique, soit la r�action inverse.
II. Diff�rentes modifications
Influence de la concentration
1. r�action directe | 2. r�action inverse
Si on augmente la concentration en I- <=> le système diminue la concentration en I- en faisant la r�action directe : Kc devient plus grand.
Influence de la temp�rature (chaleur / apport ou retrait d'�nergie)
= r�action exothermique dans le sens direct et endothermique dans le sens inverse.Si on chauffe le système <=> le système tend à diminuer la temp�rature, le système fera la r�action inverse (endothermique), Kc devient plus petit.
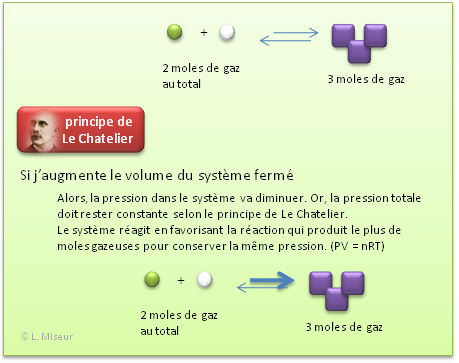
Influence de la pression (uniquement si des compos�s gazeux sont pr�sents dans la r�action)<
, soit le cas d'une bouteille d'eau gazeuse.
Si on ouvre la bouteille, la pression diminue <=> le système tendra à augmenter la pression, c'est-à-dire: augmenter le nombre de mol�cules gazeuses, soit effectuer la r�action directe.
|
|
 |
|
|
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Principe de Le Chatelier. La Chimie.net. http://www.lachimie.net | |
|
|