Les piles
Une application directe de la r�action redox est le ph�nomène des piles.
Principe g�n�ral d'une pile : Transformation d'�nergie chimique en �nergie �lectrique. Nous d�finirons le courant comme �tant un d�placement d'�lectrons.
I. La pile Daniell
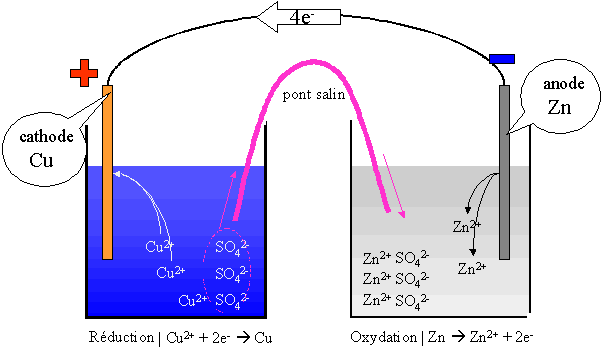
Deux couples sont en pr�sence dans cette pile : Cu / Cu2+ (SO42-) et Zn / Zn2+ (SO42-). Le couple Cu/Cu2+ fera une r�duction et le couple Zn/Zn2+ fera une oxydation.
l'oxydation se fait à l'anode (�lectrode n�gative) et la r�duction se fait à la cathode (�lectrode positive).
Au d�part, [Cu2+] = [SO42-] et [Zn2+] = [SO42-]
En fonctionnement, [Cu2+] < [SO42-] et [Zn2+] > [SO42-].
L'�lectrode de cuivre augmente de masse au cours du temps tandis que l'�lectrode de zinc va diminuer de masse au cours du temps.
Le pont salin va permettre aux ions SO42- de circuler d'un berlin à l'autre, afin que l'�lectro neutralit� soit maintenue dans chacun des berlins. Ce pont est constitu� soit d'un papier mouill� avec une solution d'un sel (NaCl, KCl, ...) soit d'un pont liquide constitu� de la solution saline.
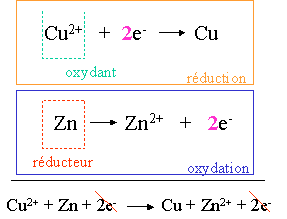
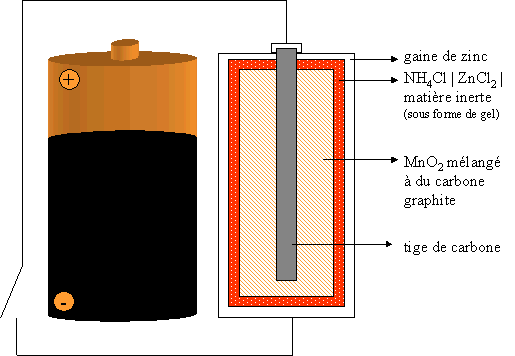
II. La pile Leclanch�, pile saline
Les deux couples redox de cette pile sont : MnO2/Mn2+ et Zn2+/Zn
En fonctionnement, à la borne positive (cathode), une r�action de r�duction se fait : la r�duction de MnO2 en Mn2+ suivant l'�quation ci-dessous :
MnO2 (s) + 4 H+ (aq)
+ 2e- ![]() Mn2+ (aq)
+ 2 H2O (l)
Mn2+ (aq)
+ 2 H2O (l)
A la borne n�gative, anode, c'est une r�action d'oxydation qui s'effectue :
Zn (s) ![]() Zn2+
(aq) + 2e-
Zn2+
(aq) + 2e-
Le gros problème de cette pile est que son "emballage" r�agit ! En effet, l'enveloppe de Zinc s'amincit au cours du temps et finit par percer. La pile finit par se trouer et la solution qu'elle contient s'�coule dans l'appareil. la solution �tant corrosive, elle cause des d�g�ts à terme à l'appareil.
III. La pile Alcaline
Il s'agit d'une variante de la pile Leclanch�. Cette pile est appel�e alcaline car elle fonctionne en milieu basique (KOH).
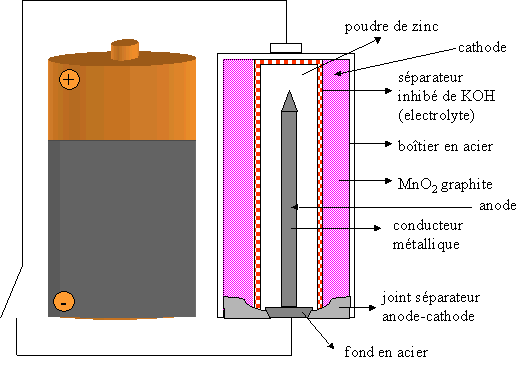
En fonctionnement, à la borne positive (cathode), une r�action de r�duction se fait : la r�duction de MnO2 en Mn2+ suivant l'�quation ci-dessous :
MnO2 + 2 H2O + 2e-
![]() Mn(OH)2 + 2 OH-
Mn(OH)2 + 2 OH-
A la borne n�gative, anode, c'est une r�action d'oxydation qui s'effectue :
Zn + 2 OH- ![]() Zn(OH)2 + 2e-
Zn(OH)2 + 2e-
Avantages de cette pile :
Elle est plus �tanche que la pile Leclanch� car le zinc ne constitue plus le bo�tier ext�rieur.
Elle a une dur�e de vie plus longue car elle renferme plus de MnO2 (oxydant) et de Zn (r�ducteur) dans le même volume qu'une pile Leclanch�.
IV. Autres piles
Il existe encore d'autres types de piles qui ne seront plus d�taill�e dans ce cours.
| Pile au mercure | Zn/Zn++ et Hg/Hg++ |
r�action en fonctionnement :
Zn + HgO + H2O + 2KOH ---------> Hg + [Zn(OH)4]K2
| Pile à combustible | 1,23 volt | H2/H+ et O--/O2 |
r�actions en fonctionnement :
| H2 + 2 OH- --------> 2 H2O + 2e | 0,83 volt | |
| 2e + ½ O2 + H2O --------> 2 OH- | 0,40 volt |
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Les piles. La Chimie.net. http://www.lachimie.net | |
|
|