Pr�vision de la r�action redox selon les r�actifs en pr�sence et titrages
Pr�vision de la r�action d'oxydor�duction lorsqu'on ne dispose que des r�actifs.
I. Principe g�n�ral :
Lorsque dans un milieu plusieurs r�actions sont envisageables, c'est en règle g�n�rale l'oxydant le plus fort qui r�agit avec le r�ducteur le plus fort. (C'est donc la r�action pour laquelle la diff�rence entre les potentiels de r�duction sera la plus importante !)
ex. : MnO4- + Fe2+ (milieu acide) ; pour cela, rep�rons tous les couples où figurent les deux substances.
|
 |
C'est donc l'ion manganate
MnO4- qui sera r�duit en Mn2+
Les demi-�quations :
8H+
+ MnO4- + 5e- ![]() Mn2+ + 4H2O
Mn2+ + 4H2O
5
( Fe2+ ![]() Fe3+ + e- )
Fe3+ + e- )
II. Exception
Fe + H2SO4 (2H+ SO42-), les couples possibles sont par ordre croissant de E0:
| Ox/Red | E0 (V) |
|
Fe2+
/ Fe |
-0,47 |
|
Fe3+ / Fe |
+0,04 |
|
H+ / H2 |
0,00 |
|
SO42-
/ H2SO3 |
+0,17 |
|
S2O82- / SO42- |
+2,01 |
Th�oriquement,
les couples devant r�agir sont "SO42-/H2SO3
2
H+ + 2e- ![]() H2
H2
Fe ![]() Fe2+ + 2 e-
Fe2+ + 2 e-
Ces exceptions ne sont v�rifiables qu'exp�rimentalement et seront notifi�es dans les exercices.
Titrages d'oxydor�duction
I. principe :
D�terminer la concentration d'une solution inconnue en d�terminant son point d'�quivalence avec une solution de concentration connue.
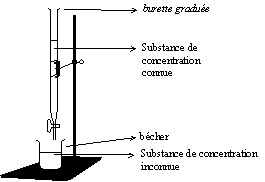
La recherche du point d'�quivalence se fait gr�ce au changement de couleur de deux espèces d'un même couple.
Lors d'un dosage d'oxydor�duction, on a à l'�quivalence nox=nred. Les espèces peuvent changer de couleur entre la forme oxyd�e et la forme r�duite, ce qui permet de rep�rer le point d'�quivalence. S'il n'y a pas de changement de couleur lors d'une r�action d'oxydor�duction, on peut utiliser un indicateur redox pour caract�riser l'�quivalence (exemple : Iode + empois d'amidon).
|
MnO4- est violet intense alors que Mn2+ est incolore |
|
|
|
|
| (c) photographie : professeur Stan Smith, Department of Chemistry, University of Illinois at Urbana-Champaign. | |
II. exemple : titrage de l'eau de javel (NaClO ; oxydant) par iodom�trie (iode) :
I2 est brun-jaune et I- est incolore
Principe g�n�ral :
Si l'on titre de l'eau de javel par iodom�trie (ajout d'iode), l'on obtient une substance brune. L'on ajoute ensuite progressivement une solution de thiosulfate de sodium. La solution d'eau de javel et d'iode s'�claircit et devient jaune. On y rajoute ensuite de l'empois d'amidon. la solution devient bleu fonc�. On continue l'ajout de thiosulfate de sodium jusqu'au moment où la solution d'eau de javel (+ iode) devient incolore. Nous sommes dès lors au point d'�quivalence (comme dans le cas des titrages acido-basiques).
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Pr�vision des r�actions d'oxydor�duction et titrages. La Chimie.net. http://www.lachimie.net | |
|
|





