Isom�rie (plane)
Des isom�res sont des compos�s qui ont la m�me formule g�n�rale (m�me nombre d'atomes identiques qui composent les mol�cules, un peu comme avec un jeu de construction o� l'on doit construire le plus de choses diff�rentes � partir de 2 blocs rouges, 5 verts et 4 bleus), mais qui n'ont pas la m�me formule d�velopp�e. On dit qu'entre ces compos�s il y a une relation d'isom�rie.
Des substances isom�res n'ont pas les m�mes propri�t�s physiques et/ou chimiques.
La disposition des atomes dans des mol�cules isom�res peut diff�rer de plusieurs fa�ons, ce qui explique l'existence de divers types d'isom�rie.
I. Isom�rie de position
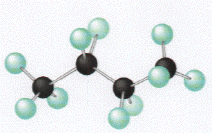
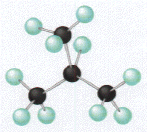
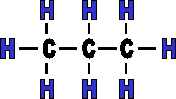
Nous avons vu qu'une mol�cule peut avoir une cha�ne carbon�e lin�aire, mais elle peut �galement �tre ramifi�e. Ci-dessous sont repr�sent�es deux mol�cules qui ont un nombre d'atomes de carbone et d'hydrog�ne identique (elles ont la m�me formule g�n�rale). Ces substances sont appel�es isom�res, pourtant leurs structures sont diff�rentes.
|
mol�cule de butane lin�aire |
mol�cule ramifi�e (isom�re du butane) |
|
|
|
|
butane (C4H10) (4+0) |
m�thylpropane (C4H10) (3+1) |
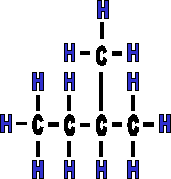
La ramification ne se met jamais sur le premier ou le dernier carbone, car dans ce cas l�, il ne s'agit plus d'une cha�ne ramifi�e, mais d'une cha�ne lin�aire. En effet; les diff�rents groupements sont en rotation autour de l'axe C - C. Attention �galement � ne pas repr�senter trop d'isom�res, la mol�cule peut "se lire" dans les deux sens. Exemple :
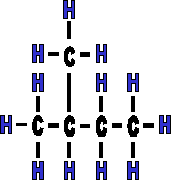 |
 |
|
Il s'agit de la m�me mol�cule mais vue d'un autre angle. Elle a subit une rotation de 180�, il ne s'agit donc pas de mol�cules isom�res, mais de mol�cules identiques. |
|
|
|
Une astuce pour ne pas oublier de repr�senter des isom�res possibles d'une substance : d�composer la mol�cule de d�part en une addition de deux �l�ments. Exemple avec un octane : (8+0 ; 7+1 ; 6+2 ; 5+3, 4+4), et lorsque la d�composition en vient � additionner les deux m�me chiffres, mais dans un autre ordre (5+3), stopper celle-ci ! |
Formules d�velopp�es et semi-d�velopp�es
Nous avons toujours repr�sent� les mol�cules de fa�on d�velopp�e, en indiquant chaque atome de carbone et la liaison qui les unit. Afin de permettre une �criture plus rapide, l'on indique la cha�ne carbon�e et ensuite le nombre d'hydrog�ne qui se rattachent � chaque atome de carbone. Exemples :
| �criture d�velopp�e | �criture semi-d�velopp�e |
|
|
CH3 - CH2 - CH3 |
| CH3 , le premier
carbone, 3 hydrog�ne sont pr�sents car il reste 3 "places"
disponibles. ( le carbone est de valence IV) CH2, deux hydrog�ne sont pr�sents sur ce carbone car 2 "places" sont disponibles. |
Lorsqu'il y a des ramifications, l'on peut soit les mettre graphiquement, soit mettre une parenth�se apr�s la formule du carbone sur lequel il se rattache.
soit : 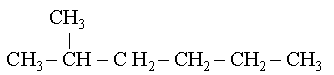
Soit : CH3-CH(CH3)-CH2-CH2-CH2-CH3
![]()
Les isom�res de position appartiennent � la m�me fonction et ne diff�rent que par la position le long de la cha�ne d'un atome ou d'un groupe d'atome. Leurs propri�t�s chimiques sont habituellement voisines, mais leurs propri�t�s physiques diff�rent (temp�rature d'�bullition, densit�, ...).
|
Les mol�cules ci-dessous sont des substance isom�re de l'octane (C8H18), vrai ou faux ? |
|
|
II. Isom�rie de constitution
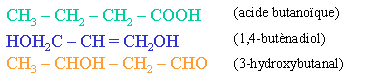
Le seul point commun entre des isom�res de constitution est qu'ils poss�dent la m�me formule g�n�rale, ainsi pour les trois mol�cules donn�es en exemple ci-dessus, la formule g�n�rale est C4H8O2. Ces isom�res n'appartiennent pas � la m�me fonction (acide; dialcool; ald�hyde-alcool). Leur isom�rie r�sulte d'un "hasard". Ces compos�s diff�rent au niveau de leurs propri�t�s chimiques et �galement au niveau de leurs propri�t�s physiques (t� d'�bullition diff�rentes, par exemple).
III. Tautom�rie
Des compos�s tautom�res, sont des isom�res de constitution qui peuvent se transformer de fa�on r�versible l'un en l'autre.
Exemple :
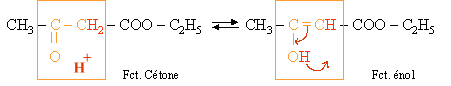
Si l'on fait r�agir un m�lange de deux formes tautom�res "A" et "B" avec un compos� r�agissant uniquement avec la forme "A", alors les mol�cules de la forme "B" se transformeront sous la forme de mol�cules "A". Il s'agit en fait d'un cas d'�quilibre chimique (voir la partie chimie min�rale).
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - cours et ressources didactiques en chimie pour apprendre les savoirs disciplinaires, les savoir-faire et comp�tences de base des sciences chimiques. La Chimie.net. http://www.lachimie.net | |
|
|