Modèle atomique quantique - Intro
Le modèle atomique de Bohr rend compte d'une s�rie de ph�nomène exp�rimentaux. Toutefois, il ne permet pas d'expliquer toutes les propri�t�s de la matière. Ce modèle s'est av�r� inexact car il appliquait des principes de la m�canique classique (lois de Newton, ...). En r�alit� au niveau des particules, un autre type de physique s'applique et les �changes d'�nergies sont alors limit�s et discontinus, quantifi�s.
A cause de cette quantification de l'�nergie que postulait Marx Planck, d'autres lois physiques ont �t� d�finies et utilis�es. Celles-ci permettent de rendre compte des observations r�alis�es au niveau atomique et font le lien avec la physique classique. En voici les grands principes afin de comprendre le modèle de l'atome quantique.
I. Dualit� onde-corpuscule :
La remise en cause la plus importante à laquelle oblige la physique quantique concerne la manière de repr�senter les objets physiques et leurs propri�t�s. L'ancienne physique, dite classique, distingue deux sortes d'entit�s fondamentales:
- les corpuscules, qui sont des sortes de billes microscopiques,
- les ondes, qui se propagent dans l'espace un peu comme le mouvement d'une vague sur la mer.
La physique quantique ne retient pas cette classification pourtant bien commode.
Les objets qu'elle considère ne sont ni des corpuscules, ni des ondes,
mais "autre chose".
Analogie :
Regard� sous deux angles diff�rents, un cylindre nous appara�t tant�t
comme un cercle, tant�t comme un rectangle. Pourtant il n'est ni l'un ni
l'autre.
Ainsi en est-il du photon, de l'�lectron ou de toute particule �l�mentaire
dont l'image corpusculaire ne serait qu'une facette d'une entit� plus complexe.
II. propri�t� ondulatoire et corpusculaire de la lumière
A la fin du XIXe siècle, James Maxwell d�finit la lumière comme �tant un faisceau d'ondes �lectromagn�tiques se d�pla�ant à vitesse constante dans le vide: la constante c = 300.000 kilomètres par seconde.
Lumière :
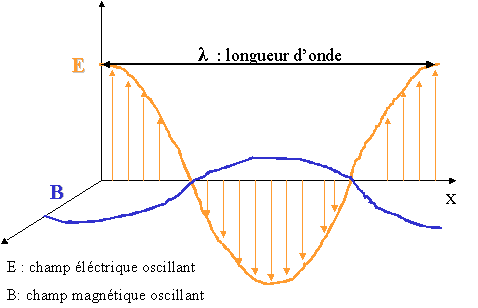
La lumière est caract�ris�e par sa fr�quence (inverse du temps mis par l'onde pour revenir à sa position initiale) ou sa longueur d'onde. La lumière visible n'est donc qu'une partie infime de l'ensemble des ondes �lectromagn�tiques.
Mais la lumière est aussi compos�e de "grains de lumière" selon Albert Einstein qui soutiendra
que l'�nergie de la lumière est en quelque sorte "granuleuse".
Ce "grain d'�nergie" sera appel� photon en 1926. Une nouvelle
particule est n�e, particule immat�rielle et sans masse.
Chaque photon d'un rayonnement (lumière, ondes radios, rayons X...) est
porteur d'un quantum d'�nergie (un certain "paquet") caract�ristique
de sa fr�quence (fr�quence de la lumière = couleur).
La physique quantique va donc associer une onde et une particule. Cette
association se g�n�ralisera d'ailleurs à toute particule, et notamment
l'�lectron.
Mais comment concilier du continu (ondes) avec du discontinu (particules)?
C'est tout le paradoxe de la dualit� onde-corpuscule
III. Origine de la lumière :
La physique quantique permet de mieux comprendre comment la lumière
est �mise par la matière...
Le modèle de l'atome de Niels Bohr �tait un modèle à la
frontière de deux �ges: l'�ge classique pr�-quantique et le monde
quantique. Mais il expliquait d�jà le m�canisme de l'�mission de lumière
par un atome :
Pour rappel :
 |
Selon le modèle de Bohr, l'�lectron tourne
autour du noyau, sur une couche �lectronique bien d�finie*.
(*) r�sultats de son exp�rimentation ! |
 |
Sous l'effet de l'�nergie thermique (chaleur) ou �lectrique ou encore par une onde �lectromagn�tique (photon), l'�lectron est excit� par cette �nergie qu'il absorbe et saute sur une couche �lectronique plus �nerg�tique. |
 |
L'�lectron est sur une couche �lectronique plus �nerg�tique. Cette situation est instable et le besoin de stabilit� l'amène à perdre cette �nergie pour se rapprocher du noyau. |  |
L'�lectron revient sur sa couche �lectronique, à son �tat fondamental. Lors de son retour, il libère, sous forme d'�nergie lumineuse (photons), l'�nergie thermique ou �lectrique qu'il avait absorb�e. |
 |
L'�lectron est à nouveau sur sa couche �lectronique d�finie. |
Ressources
de ce r�sum�: � Copyright 1997 |
|
L'�nergie de ce photon, la diff�rence d'�nergie entre l'�tat stable et excit�, sera un multiple entier (la fameuse quantification de la lumière) de la valeur hn.
- h est un nombre constant universel appel� constante de Planck. h = 6,62 x 10 -34 J.s (Joule-seconde).
- n (lettre grecque nu) est la fr�quence de la lumière (ou photon) �mise. Cette fr�quence est le nombre d'oscillations de l'onde lumineuse par seconde. Elle se mesure en Herz ou Hz. Plus la fr�quence de la lumière est �lev�e, plus son �nergie est importante et plus la couleur tend vers le bleu (et au-delà l'ultraviolet, les rayons X et Gamma). Un �lectron, faisant un "grand saut" d'une orbite atomique à une autre, �mettra donc un photon d'autant plus �nerg�tique et donc de fr�quence d'autant plus �lev�.
Inversement, l'�lectron d'un atome pourra absorber un photon d'�nergie donn�e et ainsi "sauter" d'une orbite peu �nerg�tique à une orbite plus �nerg�tique. Il sera ainsi excit� sur une orbite plus �nerg�tique que la normale. C'est en se d�sexcitant qu'il pourra r��mettre un photon.
La th�orie quantique
stipule que toutes les orbites �lectroniques ne sont pas autoris�es. Ces
orbites ne sont permises que dans la mesure où un �lectron, sautant
d'une orbite à une autre, peut �mettre ou absorber un photon d'une �nergie
multiple de la fameuse valeur hn. C'est
cette discontinuit� quantique de l'�nergie �chang�e qui entra�ne une
discontinuit� des orbites permises. Chaque orbite �lectronique autoris�e sera
donc quantifi�e et caract�ris�e par des nombres quantiques.
IV. Spectre lumineux
Chaque atome ne peut donc �mettre qu'une palette pr�cise de couleurs caract�ristiques : Chaque couleur de la lumière est en fait une fr�quence particulière (et donc un niveau d'�nergie) de photon.
Par exemple : le spectre d'�mission de lumière visible du cuivre (Cu++)
Tous les sauts d'�lectrons entre toutes les orbites possibles
au sein d'un même atome se traduisent donc par l'�mission (ou l'absorption) d'un spectre de lumière caract�ristique: Il s'agit
là d'une v�ritable carte d'identit� d'un type d'atome donn�. C'est gr�ce
à ce spectre facilement identifiable que l'on peut savoir quels atomes
existent dans les �toiles du firmament. Leur lumière est capt�e par les
t�lescopes, analys�e et compar�e avec les spectres de l'hydrogène, de
l'h�lium etc...
![]()
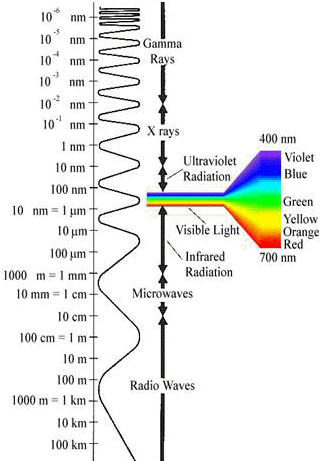
Spectre des ondes �lectromagn�tiques :
D'après http://perso.club-internet.fr/molaire1/quantic.html | (c) Illustrations : WOLLBRETT Cyberic
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Mod�le atomique quantique (intro). La Chimie.net. http://www.lachimie.net | |
|
|