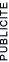Dilution d'une solution
I. Le principe
Diluer une solution, c'est diminuer sa concentration. Pour se faire, on rajoute une quantit� de solvant (souvent de l'eau distill�e) à un volume pr�cis de la solution initiale.
Soit une dilution à 50% : cela signifie que la concentration est divis�e par 2. On doit donc diviser par 2 le nombre de mol�cules pr�sentes par litre de solution. Une fa�on de proc�der serait d'ajouter le même volume de solvant que de solution initiale.
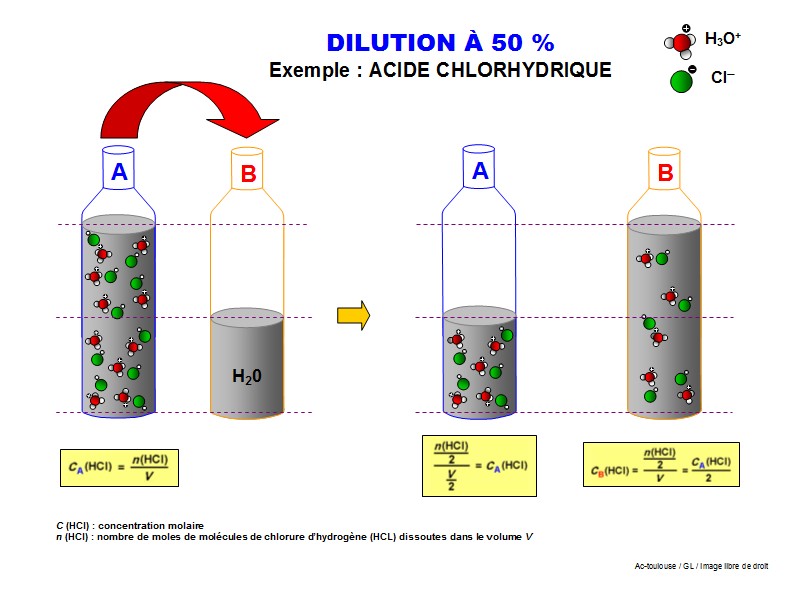
Pour r�aliser une solution dilu�e à 10%, on prendra un volume (1/10) de la solution concentr�e et on ajoutera 9 fois ce volume de solvant. (soit 9/10).
II. En pratique
Pour des raisons �conomiques et �cologiques, on essaye de limiter au minimum les pertes de produits. On essaye donc de pr�parer les quantit�s de solutions dont nous avons besoin.
Les volumes pr�lev�s doivent être très pr�cis afin de r�aliser une bonne dilution, c'est pourquoi du mat�riel sp�cifique à ces op�rations existe.
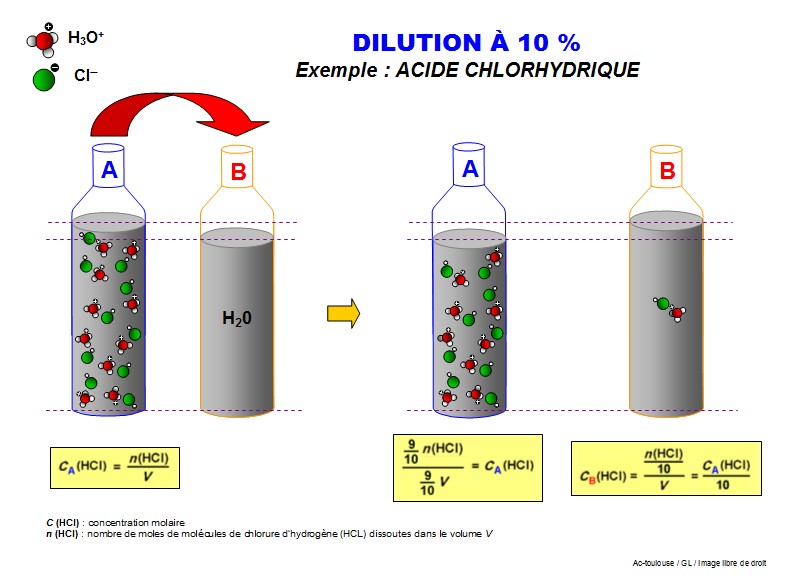
Pipette jaug�e (c'est une pipette qui est calibr�e afin de pr�lever un volume très pr�cis�ment. Elle existe en plusieurs capacit�s 1mL à 200mL et plus !)
Pipette jaugée
Fiole jaug�e - ou [jaug�] (il s'agit d'une fiole calibr�e qui permet d'obtenir un volume exacte lors de l'addition de solvant)
Fiole jaugée
Donc en pratique, si je veux diluer 10 fois une solution, j'utilise par exemple une pipette jaug�e de 10 mL et une fiole jaug�e de 100 mL (100/10 = 10 fois).
Calcule les dilutions r�alis�es en utilisant la verrerie indiqu�e
dilution pipette jaug�e fiole jaug�e rapport 1 mL 10 mL 10/1 2 mL 10 mL 10/2 10 mL 30 mL 30/10 50 mL 100 mL 100/50
Exemple r�solu
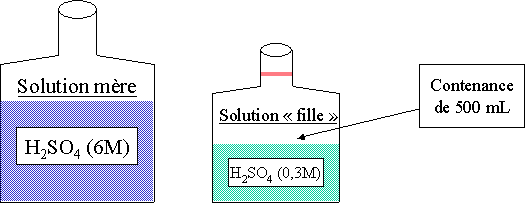
calculer le volume d'une solution aqueuse 6M de H2SO4 , qu'il faut pr�lever pour obtenir 500 mL de H2SO4 0,3 M.
1. D�terminer le nombre de moles de la solution à pr�parer : 1000 mL --> 0,3 mole 500 mL --> 0,15 mole 2. Il faut donc pr�lever 0,15 mole de la solution mère. 3. 1000 mL --> 6 moles 25 mL --> 0,15 mole (0.15 . 1000)/6 4. R�pondre à la question : Il faut donc 25 mL de la solution mère à 6M et rajouter de l'eau distill�e dans le r�cipient jusqu'au trait de jauge. Loi des concentrations
De cet exemple, nous pouvons tirer une loi :
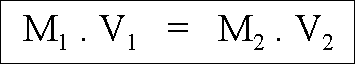
La molarit� d'une solution mère (M1) multipli�e par son volume (V1) est �gale à la molarit� d'une solution fille (M2) que multiplie son volume (V2), avec M, la molarit� de la solution exprim�e en M/L ou Molaire et V, le volume de la solution exprim� en litre(s).
Ce qui donne pour l'exemple ci dessus : 6 . 0,025 = 0,3 . 0,5 on peut donc retrouver le volume qu'il nous fallait en utilisant cette formule : 6 . X = 0,3 . 0,5 --> X = (0,3 . 0,5) / 6 = 0,025 L soit 25 mL.
Ne pas oublier que l'on travaille en litres (L) avec cette loi.
Ci-dessous : une solution de KMnO4 (permanganate de potassium) de concentration 1g/10mL dilu�e 10 fois entre chaque tube. Nous remarquons que la couleur des solutions dilu�es diminue avec la dilution. Ceci montre bien que les solutions dilu�es contiennent moins de mol�cules que les solutions concentr�es.
Solution de KMnO4 (1g / 10 mL) - dilu�e 10x, 100x et 1000x.
Une solution dilu�e 1/1000 de KMnO4 peut être utilis�e afin de traiter des affections cutan�es de type mycoses.
(c) photo : E. Mayn� 2010
Simulateur : Concentration et molarit�

|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Dilution d'une solution. La Chimie.net. http://www.lachimie.net | |
|
|