Les solutions ioniques
I. Introduction
I.1. Qu'est ce qu'une solution ?
Une solution est un m�lange homogène (dont on ne peut distinguer les
composants) d'un solvant (la quantit� majoritaire) et d'un ou plusieurs solut�s.
Par exemple : 5 mL d'�thanol dans 50 mL d'eau; l'eau est le solvant et l'�thanol
le solut�.
Dissolution = Action de dissoudre le solut� dans le solvant.
I.2. Exp�rience
 |
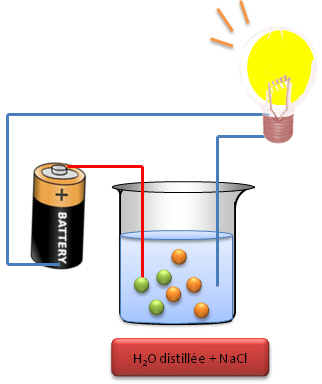 |
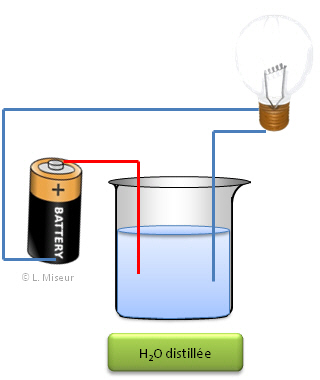
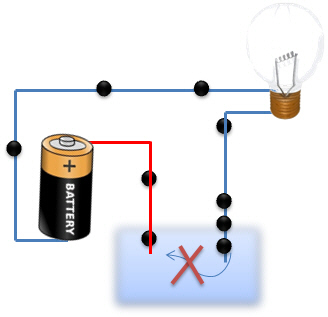
| Avec un r�cipient rempli uniquement avec de l'eau
distill�e (sans ions); la lampe ne s'allume pas alors qu'avec un r�cipient
dans lequel on a mis une solution de NaCl (sel de cuisine + eau distill�e),
l'on observe que l'ampoule s'allume. Une solution ionique est donc
conductrice (permet le passage du courant).
|
|
I.3. Interpr�tation
Lorsque l'on plonge un cristal de chlorure de sodium (NaCl), qui est un solide compos� d'entit�s charg�es : les ions Na+ et Cl-, l'eau va agir afin de rompre les interactions �lectriques qui lient les diff�rents ions. Les ions vont être ainsi isol�s les uns des autres par une "enveloppe" de mol�cules d'eau. Nous avons alors dans la solution des entit�s charg�es positivement et n�gativement.
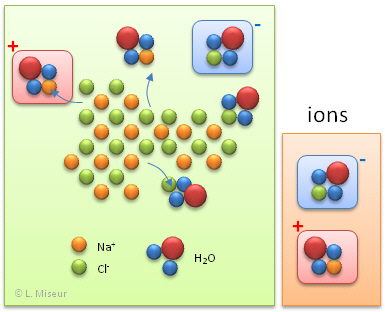
Quand dans le premier cas, nous plongeons deux fils �lectriques, le courant, qui est un flux de particules n�gatives (![]() ) n'est pas transport� par l'eau distill�e. Il n'y a en effet aucun transporteur de charges capables de transporter les �lectrons d'une �lectrode à l'autre. Le circuit est alors ouvert, les �lectrons sont bloqu�s.
) n'est pas transport� par l'eau distill�e. Il n'y a en effet aucun transporteur de charges capables de transporter les �lectrons d'une �lectrode à l'autre. Le circuit est alors ouvert, les �lectrons sont bloqu�s.
Dans le deuxième cas, les �lectrodes baignent dans une solution qui contient des ions positifs et n�gatifs. Ces ions vont servir de "transporteurs" afin d'amener les ![]() d'une �lectrode à l'autre. Le circuit est alors ferm� et l'ampoule s'allume.
d'une �lectrode à l'autre. Le circuit est alors ferm� et l'ampoule s'allume.
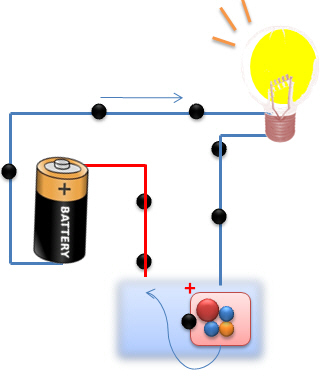
Une des propri�t�s des solutions ioniques : elles permettent le passage d'�lectrons. Et comme le courant �lectrique peut être d�fini comme le passage d'�lectrons dans un conducteur, nous pouvons dire qu'une solution ionique permet la conduction d'un courant �lectrique.
II. �criture des �quations de dissociation
Les compos�s ioniques r�agissent avec l'eau. L'eau s�pare les diff�rents ions en les entourant de ses mol�cules. Les forces �lectriques liant ces ions sous forme d'un solide n'agissent plus suffisamment et les ions se r�partissent dans le solvant (l'eau).
Dans le cas de certains compos�s pr�sentant des liaisons polaris�es, la s�paration en ions par r�action avec l'eau est �galement possible.
Les �l�ments dans le tableau p�riodique ne s'ionisent pas tous de la même
fa�on. Certains perdent des �lectrons et
d'autres en gagnent, voici les charges que prennent de fa�on pr�f�rentielle les �l�ments
selon leurs familles.
|
famille |
1 |
2
|
13
|
14
|
15
|
16
|
17
|
18
|
|
ionisation |
X+ |
X2+ |
X3+ |
(*) |
X3- |
X2- |
X- |
- |
(*) Certains �l�ments de la famille 14 (Sn, Pb) forment des ions positifs.
Les �l�ments des familles 3 à 12 peuvent former plusieurs types d'ions, celle-ci
d�pendra de l'�l�ment avec lequel ils sont associ�s, il faudra dans ce cas
retrouver la valence de l'�l�ment par la règle du chiasme.
Ionisation pour les groupements d'atomes
|
NH4 |
NH4 + |
|
OH |
OH - |
Tous les autres groupements (à l'exception de NH4) sont des ions n�gatifs dont la charge peut
être trouv�e par l'acide dont ils proviennent ou par la règle du
chiasme !
Comment �crire une r�action de dissociation ?
|
1. |
V�rifier qu'il y a au moins
un compos� m�tallique composant la mol�cule solide |
MX(s) | exemple : CaCl2(s) |
|
2. |
�crire la
formule mol�culaire du compos� dans le membre de gauche. |
MX(s)
|
|
3. |
Dans le
membre de droite d�composer la formule mol�culaire en parties M et X |
MX(s)
|
|
4. |
Pond�rez l'�quation |
MX(s)
|
|
5. |
Dans le
membre de droite ajouter les charges à M et X selon leur place dans
le tableau p�riodique |
MX
|
|
6. |
V�rifier
que la somme alg�brique des charges est bien nulle. |
(2+
+ 2- = 0) |
![]() Les (s)et les (aq) nous informent sur
l'�tat de la mol�cule, ainsi (s) signifie à l'�tat solide et (aq)
à l'�tat aqueux, en solution. N'oubliez pas d'indiquer ces informations
!
Les (s)et les (aq) nous informent sur
l'�tat de la mol�cule, ainsi (s) signifie à l'�tat solide et (aq)
à l'�tat aqueux, en solution. N'oubliez pas d'indiquer ces informations
!
III. Solut� ionophore ou ionogène ? :
D�finition : un solut� est ionophore
si les ions lib�r�s lors de la dissolution de celui-ci dans un solvant pr�existaient dans ce compos�.
C'est le cas de compos�s ioniques tels que NaCl(s), CuCl2(s), NaOH(s), ...
Dans les exemples ci-dessus, les ions form�s par la dissolution des compos�s ioniques cit�s sont :NaCl (s)
Na+(aq) + Cl-(aq)
CuCl2(s)
Cu2+(aq) + 2 Cl- (aq)
...
Les ions ainsi form�s s'entourent ensuite d'un certain nombre de mol�cules d'eau.
D�finition : Un solut� est ionogène
si les ions lib�r�s lors de sa dissolution ne pr�existaient pas dans ce compos�. La pr�sence d'ions en solution aqueuse r�sulte alors d'une r�action chimique entre le solut� et les mol�cules d'eau.
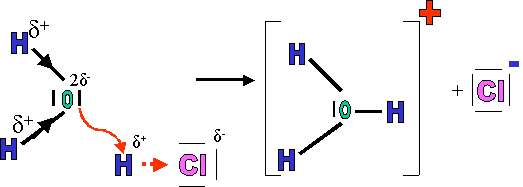
Par exemple, lors de la dissolution d'HCl(g) dans l'eau, L'hydrogène formant la mol�cule HCl(g) se d�tache pour aller se fixer sur l'oxygène d'une mol�cule d'eau.
Au cours de cette r�action, se sont form�s des ions qui ne pr�existaient pas dans les mol�cules composant le solut�. Cette r�action se nomme : r�action d'ionisation.
D'autres compos�s ionogènes forment �galement des ions par r�action d'ionisation, il s'agit pour la plupart de compos�s polaires. ( H2SO4, CH3COOH, NH3, ...).

|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Solutions ioniques. La Chimie.net. http://www.lachimie.net | |
|
|