La mole - La masse molaire
I. Qu'est-ce qu'une mole ?
Une mole est une quantit� d'atomes OU de mol�cules.
Un atome, une mol�cule, c'est quelque chose de microscopique. En prenant une grande quantit� d'atomes, une mole, on obtient un ensemble mesurable d'un point de vue macroscopique. Nous pouvons peser, par-exemple, la masse d'une mole de sel de cuisine (NaCl) avec une simple balance alors qu'on ne peut pas peser la masse d'une mol�cule de NaCl.
Une mole, c'est comme dire : une paire de chaussettes (2 chaussettes); une douzaine d'�ufs (12 �ufs); une rame de papier (500 feuilles); un quatuor de musiciens (4 musiciens)...
Que vaut une mole ? Dans une mole , il y a 6,02252 . 1023 mol�cules ou atomes.
Mais on pourrait aussi dire, une mole de grains de riz, ce qui �quivaut � prendre 6,02252 . 1023 grains de riz.
Ce nombre particulier, 6,02252 . 1023 a �t� d�fini et se note : NA, le nombre d' Avogadro (Nous utiliserons la valeur arrondie � 6. 1023 ).
Voici ce que repr�sente une mole de diff�rentes substances
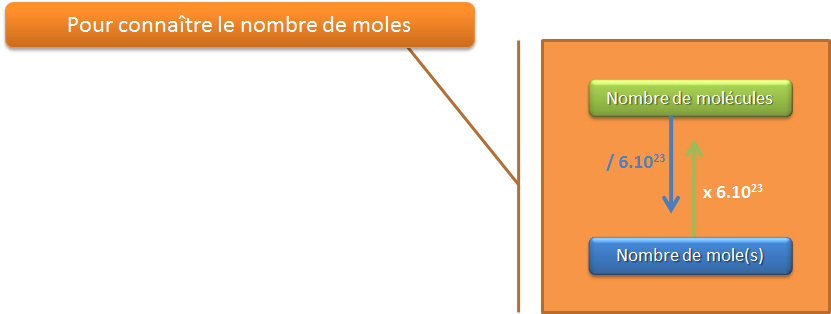
Comment savoir combien de moles ai-je besoin afin d'effectuer une r�action chimique et dans quelle proportion celle-ci r�gira-t-elle ?
La r�ponse � cette question a d�j� �t� donn�e par Lavoisier et sa loi de pond�ration. Les coefficients indiquent le nombre de mole des r�actifs qu'il faut mettre en pr�sence pour produire un nombre de mole de produit. Ces coefficients donnent les proportions entre les r�actifs et les produits. Tout comme il faut 250 g de beurre, 250 g de lait, 250 g de farine et 250 g d'�ufs pour faire 1 g�teau !
Exemple
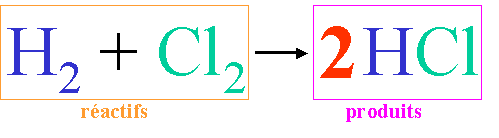
C'est les coefficients qui d�terminent le(s) nombre(s) de mole(s). (rappel : pas de chiffre devant une mol�cule signifie 1 mol�cule ou 1 mole de mol�cules).
lecture molaire de l'�quation chimique ci-dessus: 1 mole de dihydrog�ne r�agit avec 1 mole de dichlore pour former : 2 moles de chlorure d'hydrog�ne (2 moles d'acide chlorhydrique).
Ce qui signifie que pour former 2 moles d'HCl, je dois mettre en pr�sence 1 mole de dichlore et 1 mole de dihydrog�ne. Les proportions sont donc de 1, 1 pour 2
|
|
II. Quelle masse poss�de une mole de mol�cules ou d'atomes ?

Par d�finition, une mole de de 12C (isotope 12 du Carbone) vaut 12g. Et correspond � 6,02252 . 1023 atomes de l'isotope 12 du Carbone.
Donc, pour exprimer la masse d'une mole d'atomes ou de mol�cules en une mesure connue : le gramme, il suffit de calculer la masse mol�culaire relative (ou masse atomique relative) de tous ses composants et d'y rajouter l'unit� g.mol-1. Celle-ci signifie bien ...grammes pour 1 mole.
![]() La masse molaire se note
M
.
La masse molaire se note
M
.
Exemple illustr� d'utilisation de la masse molaire pour calculer la masse totale de 2 moles de HCl
(H2 : 1 g.mol-1 x 2 mol = 2g de dihydrog�ne + Cl2 : 35 g.mol-1 x 2 mol = 70 g de dichlore donnent : 2 moles d' HCl soit :( 1g.mol-1 + 35 g.mol-1 ) x 2 mol = 36 g.mol-1 x 2 mol = 72 g ) (rem : la loi de Lavoisier a bien �t� respect�e car la masse des r�actifs est �gale a la masse des produits.
Dans cet exemple; la masse d'une mole de H2 (Dihydrog�ne) vaut 2 grammes : H2 : la masse molaire du dihydrog�ne est de 2 g.mol-1.
![]() La masse molaire
s'exprime en gramme(s) par mole (g.mol-1).
La masse molaire
s'exprime en gramme(s) par mole (g.mol-1).
Rappel des diff�rentes indications concernant la masse des atomes et des mol�cules :
La masse atomique relative d'un atome, se note Ar et ne poss�de pas d'unit�s.
La masse mol�culaire relative, se note Mr et ne poss�de pas d'unit�s.
La masse molaire, se note M et est exprim�e en g.mol-1 que l'on peut noter aussi g/mole.
Exercices
![]()
III. Application - D�termination exp�rimentale d'une formule chimique.
Il est souvent demand� aux chimistes
d'identifier une s�rie de substances et d'en donner les composants. Une premi�re
approche est l'analyse �l�mentaire du m�lange (pouvoir dire quels sont les �l�ments pr�sents dans le m�lange).
Cette analyse permet de conna�tre les proportions
et la nature des diff�rents �l�ments contenus dans l'�chantillon � analyser
et l'on pourra ensuite tenter d'en d�duire les mol�cules dont il est compos�.
-
analyse �chantillon A
| El�ment | Zn | O | S |
| % en masse | 40,5 | 39,6 | 13,9 |
| nombre de gramme dans 100 grammes d'�chantillon | 40,5 | 39,6 | 13,9 |
| nombre de moles | 40,5/65.4(=
M
Zn)
0,62 mol |
39,6/16 (=
M
O)
2,245 mol |
13,9/32 = (
M
S)
0,62 mol |
| proportions (nombres entiers) | 1 | 4 | 1 |
| mol�cule probable | ZnSO4 | ||
-
analyse �chantillon B
| El�ment | K | Cr | O |
| % en masse | 26.6 | 35.4 | 38 |
| nombre de gramme dans 100 grammes d'�chantillon | 26.6 | 35.4 | 38 |
| nombre de moles | 26.6/39.1
0.68 |
35.4/52
0.68 |
38/16
2.375 |
| proportions (nombres entiers) | 2 | 2 | 7 |
| mol�cule probable | K2Cr2O7 | ||
|
|
|
| |||||||||
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - La mole. La Chimie.net. http://www.lachimie.net | |
|
|





