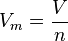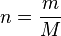Volume molaire d'un gaz parfait
I. D�finition
- Le volume molaire d'un gaz parfait est le volume occup� par une mole de n'importe
quel gaz parfait dans des conditions normales
de temp�rature et de pression.
( � savoir : 1,013.105 Pa [1013 hPa] et 0� Celsius [273,15
Kelvin]). Cette condition se note
CNTP ou TPN.
- Ce volume est de 22,41 L - 0,02241 m� dans les conditions NTP.
- Sauf indications contraires, le volume molaire d'un gaz est toujours exprim� selon les CNTP !
- 1 mole de compos� � l'�tat gazeux occupera un volume de 22,4 L
unit� du volume molaire :
Son unit� est le litre par mole (L�mol-1). Dans les unit�s du syst�me international, le volume molaire s'exprime en m�tres cubes par mole (m3�mol-1).
- Conditions de laboratoire | Convention (CL)
Pression = pression atmosph�rique (1013 hPa) et temp�rature fix�e � 25�C (298,15 Kelvin) ; Le volume molaire d'un gaz vaut alors 24,47 L�mol-1 que nous estimerons � 24 L�mol-1
Le volume molaire est une grandeur physico-chimique qui d�pend de l'�l�vation de la temp�rature et de la pression.
II. Formules
Le volume molaire peut se calculer en utilisant la formule :
Cette formule s'applique aux gaz uniquement avec
-
V , le volume en litres et
-
n la quantit� de mati�re en moles.
En utilisant la formule de calcul de la masse molaire M
on peut d�terminer une seconde formule :
-
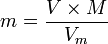 .
.
![]() Pour calculer le
nombre de moles d'un gaz parfait dans d'autres conditions, la formule suivante est � appliquer :
P. V = n. R. T. o�, P = la pression exprim�e en Pa, V
est �gale au volume (en m�), n est la quantit� de mati�re (nombre
de moles), R = la constante du gaz parfait (8,314) et T, la temp�rature
absolue exprim�e avec l'�chelle de Kelvin.
Pour calculer le
nombre de moles d'un gaz parfait dans d'autres conditions, la formule suivante est � appliquer :
P. V = n. R. T. o�, P = la pression exprim�e en Pa, V
est �gale au volume (en m�), n est la quantit� de mati�re (nombre
de moles), R = la constante du gaz parfait (8,314) et T, la temp�rature
absolue exprim�e avec l'�chelle de Kelvin.
On peut aussi utiliser la relation des gaz parfaits :
-
pV = nRT
afin de d�terminer le volume molaire selon la formule :
-
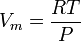 .
.
Dans les exercices, nous utiliserons pour la pression : 1 atm , le volume sera exprim� en litre , et R vaudra alors 0,082. Il s'agit d'unit�s plus courantes en chimie et en thermodynamique chimique.
|
|
|
|
 | |
R�serv� à une utilisation strictement priv�e-tous droits de reproduction et de diffusion r�serv�s - (c) L. Miseur - La chimie.net 2012 | |
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Volume molaire d'un gaz. La Chimie.net. http://www.lachimie.net | |
|
|