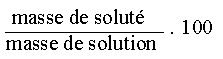Concentration d'une solution
I. La concentration molaire
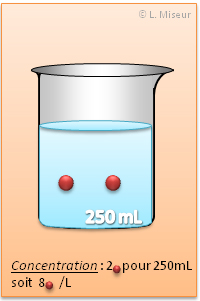
D�finition
C'est le nombre de mole pr�sentes par volume de solution.
Cette concentration est la plus couramment utilis�e lorsque l'on travaille avec des solutions.
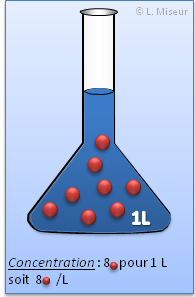
Les concentrations molaire sont exprim�es par-rapport � 1 LITRE de solution. C'est donc le nombre de mole pr�sent pour 1 litre de solution.
Formulation math�matique
Unit�
mol.L-1 ou mol/L
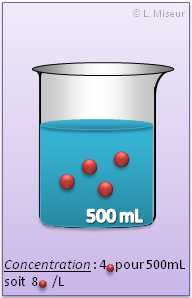
Une solution de concentration 1 mol.L-1 contient 1 mole de solut� dans 1 litre de solution.
Laboratoire virtuel : r�aliser des solutions
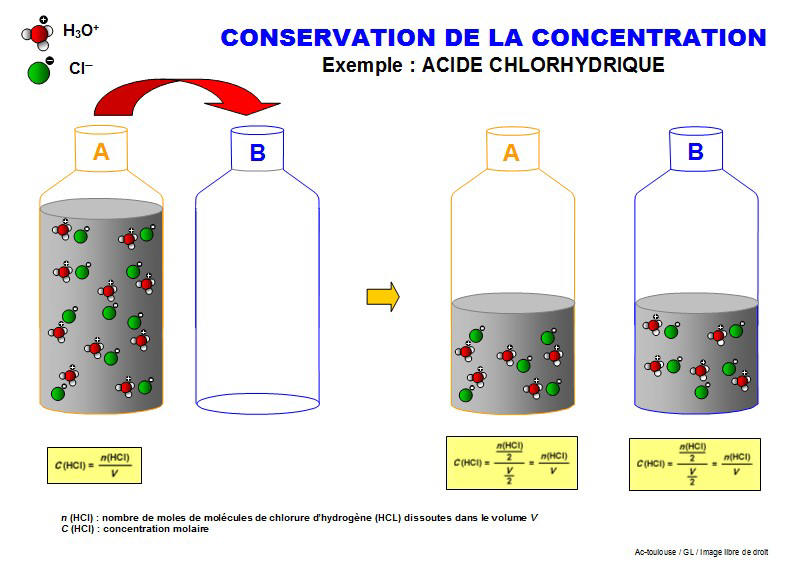
II. Influence du volume sur la concentration molaire
II.1. Variation de la concentration
II.2. Th�orie
La concentration molaire est toujours exprim�e pour 1 Litre de solution ! (mol/L). D�s lors, si je prends un �chantillon de 10 mL d'une solution 3,5 mol/L, la concentration de cet �chantillon sera toujours 3,5 mol/L !
III. Autres expressions de la concentration
Il existe plusieurs autres expressions de la concentration :
III.1. La concentration massique
Cette concentration prend en compte le rapport de la masse de solut� et le volume total de la solution.
, l'unit� de concentration massique est le g/L (gramme par litre)
III.2. Le % en masse
III.3. La molalit�
Nombre de moles de solut� / masse de solution ( unit� : mol.kg-1)

III.4. Titre en volume ou fraction volumique >
Volume de solut� / volume total de la solution
ex: 9 ml d'HCl pour 100ml d'H2O
III.5. Titre en masse ou fraction massique
Masse de solut� / masse total de la solution
ex: 9 g d'HCl pour 100g de solution d'HCl+H2O
III.6. Titre en moles ou fraction molaire
Nombre de mole de solut� / nombre de moles total
ex: 9 moles d'HCl pour 100 moles de solution d'HCl.
IV.Exercices
![]()
|
|
|
| |||||||||
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Concentration d'une solution (C). La Chimie.net. http://www.lachimie.net | |
|
|