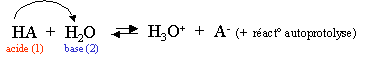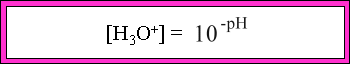L'autoprotolyse de l'eau et le pH
I. L'autoprotolyse de l'eau
Mesurons la conductivit� d'une solution d'eau d�min�ralis�e ( qui � priori ne contient pas d'ions). La mesure de conductivit� obtenue n'est pas nulle, � 25�C, la conductivit� de l'eau d�min�ralis�e est de 5,5 .10-6 S.
L'eau d�min�ralis�e contient donc des ions. Voici l'�quation de la r�action acido-basique de l'eau :
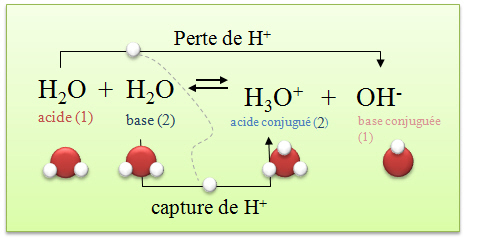
Les couples acides-bases sont : H2O/OH- et H3O+/H2O.
Il y a donc des ions libres dans l'eau. La conductivit� est cependant tr�s faible, cette r�action doit donc aboutir � un �tat d'�quilibre avec de tr�s faibles concentrations de OH- et H3O+. Cet �tat d'�quilibre est appel� �quilibre d'autoprotolyse de l'eau. Comme il s'agit d'une r�action aboutissant � un �tat d'�quilibre, nous pouvons calculer la constante d'�quilibre, celle-ci est particuli�re et se note Kw.
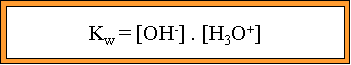
Dans toute solution aqueuse, le produit des concentrations des ions OH- et H3O+ est une constante. Ce produit se nomme PRODUIT IONIQUE DE L'EAU. Sa valeur est de :

Attention ! Cette valeur n'est valable qu'� 25�C, en effet Kw varie avec la temp�rature. Voici des mesures exp�rimentales prises � diff�rentes temp�ratures :
| T (�C) | 0 | 15 | 20 | 25 | 30 | 60 | 100 |
| Kw | 2 . 10-15 | 2 . 10-15 | 4,5 .10-15 | 10-14 | 4,5 . 10-14 | 10-13 | 3,7 .10-13 |
Concentration des ions OH- et H3O+ dans l'eau pure.
�quation : 2 H2O ![]() H3O+ + OH- ; dans l'eau pure il y a
autant de mole d'ions OH- que de mole d'ions H3O+.
Nous pouvons donc retrouver les concentrations de ces ions.
H3O+ + OH- ; dans l'eau pure il y a
autant de mole d'ions OH- que de mole d'ions H3O+.
Nous pouvons donc retrouver les concentrations de ces ions.
![]()
II. Milieu acide, milieu basique
II.1. Un acide dans l'eau :
=> Une solution est acide si : [H3O+] > [OH-].
Exemple :
[ H3O+] = 10-3 mol.L-1 => [OH-] = 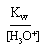
= 10-14/10-3 = 10-11 mol.L-1 II.2. Une base dans l'eau :
=> Une solution est basique si [H3O+] < [OH-].
Exemple :
[OH-] = 10-4 mol.L-1 => [H3O+] = 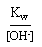
= 10-14/10-4 = 10-10 mol.L-1
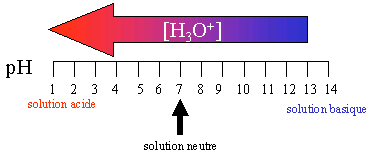
III. Echelle d'acidit� et pH
III.1.Echelle de pH
Cette �chelle bas�e sur la concentration en ions H3O+ n'est pas tr�s pratique, car les concentrations peuvent varier de 10-14 � 1 ! Une autre �chelle a �t� mise en place pour pouvoir comparer plus facilement l'acidit�, il s'agit de l'�chelle de pH.
Le pH d'une solution est �gale � la relation :
o� log est la fonction logarithmique en base 10 et
[H3O+] est la concentration en ions H3O+.
Exemple : si une solution acide a une concentration en H3O+ �gale � 10-8 son pH = -log 10-8 = 8
si [H3O+] = 10-5 ; pH = -log 10-5 = 5.
Par cons�quent, connaissant le pH, l'on peut retrouver la concentration en ions [H3O+] par la relation suivante :
Sur l'�chelle des pH, l'acidit� ne varie donc que de 0 � 14.
Notons que lorsque le pH augmente, la concentration en H3O+ diminue.
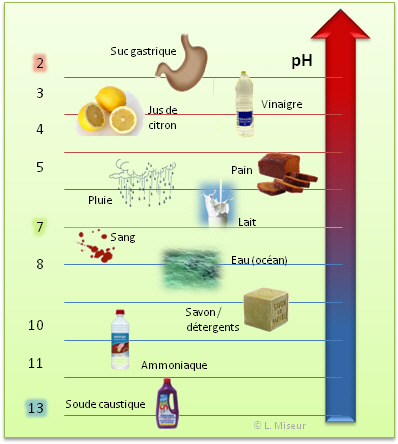
III.2. Quelques exemples de la vie courante

III.3. Mesure du pH
Il existe deux m�thodes permettant de mesurer le pH d'une solution :
III.3.1. Les papiers indicateurs universels.
Pour mesurer le pH, il suffit de d�poser une goutte de solution sur la languette de papier pH et de comparer la couleur obtenue avec le panel de couleurs fourni avec le papier. Attention ! Un papier pH est compos� d'un m�lange de diff�rentes substances qui changent de couleurs selon les concentrations en H3O+ que contient la solution. Voici un tableau de ces diff�rentes substances ainsi que la valeur de pH pour laquelle elles changent de couleur : (On peut �galement utiliser ces substances seules directement dans les solutions pour d�terminer le pH selon la couleur obtenue).
(c) Claude Abraham : http://cabraham.ep.profweb.qc.ca
III.3.2. Le pH-m�tre :
Il s'agit d'un appareil constitu� de deux parties : une �lectrode que l'on plonge dans la solution et un voltm�tre �lectronique dont l'�chelle est gradu�e directement en unit�s de pH.
IV.Exercices
![]()
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Autoprotolyse de l'eau et le pH. La Chimie.net. http://www.lachimie.net | |
|
|