Configuration �lectronique des �l�ments
Nous avons vu que chaque �lectron d'un atome peut �tre caract�ris� par 4 nombres quantiques : m, l, ml, ms. Regardons, maintenant, gr�ce � ces coordonn�es et � quelques r�gles simples comment se placent les �lectrons autour du noyau.
I. Principe d'exclusion de Pauli
m, l, ml, ms , caract�risent un et un seul �lectron. En effet, deux �lectrons d'un m�me �l�ment diff�rent d'au moins un des nombres quantiques. Par cons�quent, il peut y avoir au maximum deux �lectrons par orbitales diff�rant chacun par leur spin (+1/2 pour le premier �lectron et - 1/2 pour le second).
On peut r�sumer le principe d'exclusion de Pauli comme ceci : Dans chaque couche, l'on peut mettre au maximum 2n� �lectrons. (o� n est le num�ro de la couche).
II. Niveaux d'�nergie
Chacune des couches et sous-couches repr�sentent en fait un niveau d'�nergie. Ces niveaux d'�nergie augmentent en partant du centre vers l'ext�rieur de l'atome.
Voici le graphique repr�sentant les diff�rentes couches et sous-couches et le niveau d'�nergie qui leur est associ� :
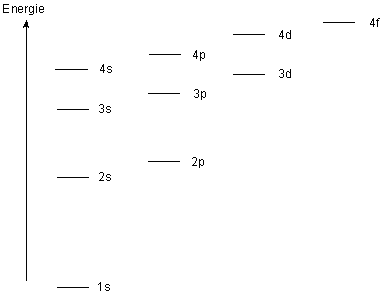
Nous pouvons remarquer que le niveau d'�nergie 3d est tr�s tr�s proche du niveau 4s.
III. Principe de construction des atomes
Les �lectrons se disposent autour du noyau de mani�re � ce que leur niveau d'�nergie soit le plus bas. Pour les niveaux les plus inf�rieurs, ils se remplissent selon l'ordre intuitif (1s, 2s, 2d ,...). Mais � partir du niveau 3p, l'�cart d'�nergie entre les orbitales diminue et l'ordre de remplissage diff�re de l'ordre intuitif.
La r�gle de Klechkowsky permet de retenir l'ordre dans lequel se placent les �lectrons autour d'un noyau :
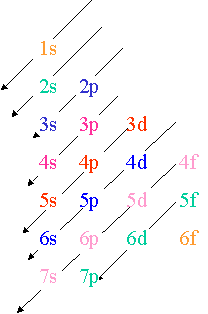 |
Les �lectrons remplissent progressivement les orbitales dans l'ordre indiqu� par les fl�ches (diagonales)
|
IV. R�gle de Hund
Dans des orbitales de m�me �nergie (dans une m�me couche), les �lectrons se placent de pr�f�rence avec leurs spins parall�les (m�me chiffre) dans des orbitales diff�rentes. Ceci s'expliquant par un gain d'�nergie.
V. Notation et symboles
Nous avons maintenant r�uni toutes les r�gles pour pouvoir d�tailler la structure �lectronique de n'importe quel atome. Voyons maintenant comment l'�crire.
ex : Carbone C - 6 �lectrons
sa structure �lectronique est : 1s� 2s� 2p� o� les chiffres en bleu repr�sentent la couche, la lettre la sous-couche et l'exposant le nombre d'�lectrons contenus dans la sous-couche. La somme des exposants donnant donc le nombre total d'�lectrons.
![]() Attention !
Pour pouvoir entamer le remplissage d'une nouvelle couche, il faut que toutes
celles de niveaux d'�nergie inf�rieurs soient remplies !
Attention !
Pour pouvoir entamer le remplissage d'une nouvelle couche, il faut que toutes
celles de niveaux d'�nergie inf�rieurs soient remplies !
-
Notation abr�g�e :
ex : Calcium - Ca - 20e-
sa structure �lectronique peut se noter : [Ar] 4s�
Ce qui signifie que l'atome de calcium poss�de la m�me configuration que le gaz rare Argon + 4s�. Cette notation abr�g�e fonctionne comme ceci : on donne entre crochet le symbole du gaz rare (He, Ar, Kr, Xe, Rn) et l'on indique ensuite ce qu'il y a en plus de cette configuration du gaz rare.
![]() Attention
! Pour les �l�ments de num�ro atomique 1 � 10, la notation abr�g�e n'existe
pas !
Attention
! Pour les �l�ments de num�ro atomique 1 � 10, la notation abr�g�e n'existe
pas !
Exemples :
-
Cu (29e-) : structure compl�te : 1s� 2s� 2p6 3s� 3p6 3d10 4s� | notation abr�g�e : [Ar] 3d10 4s1
-
He (2e-) : 1s�
-
O (8e-) : 1s� 2s� 2p4
-
Cl (17e-) : 1s� 2s� 2p6 3s� 3p5 | [Ne] 3s� 3p5
-
On repr�sente �galement les orbitales et les couches par des "cases atomiques". Chaque case repr�sentant une orbitale (donc 2e- de spin antiparall�le) et l'ensemble de cases accol�es symbolisera la couche.
case de la couche 1s avec ces deux �lectrons repr�sent�s chacun par une fl�che dont le sens symbolise le spin de l'�lectron. Les orbitales s peuvent accueillir au maximum 2 �lectrons.
cases de sous couche p. Les orbitales p peuvent accueillir au maximum 6 �lectrons.
cases de sous couches d. Les orbitales d peuvent accueillir au maximum 10 �lectrons.
Pour chaque sous couche, le nombre de cases augmente de 2. et chaque couche peut contenir au maximum 2n� �lectrons.
Compte tenu de toutes les r�gles �nonc�es ci-dessus, voici la configuration �lectronique de l'atome de Soufre (S) compos� de 16e- : 1s� 2s� 2p6 3s� 3p4

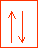
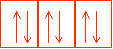
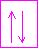
Et celle du Silicium (Si) 14e- : 1s� 2s� 2p6 3s� 3p2

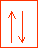
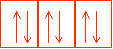
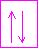
|
|
 |
|
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Configuration �lectronique. La Chimie.net. http://www.lachimie.net | |
|
|


