�quilibre chimique
I. R�actions compl�tes, �quilibr�es et incompl�tes.
R�action compl�te : Se d�roule jusqu'� �puisement d'un r�actif au moins.
2 HCl + Ca(OH)2 CaCl2 + 2 H2O
. d�but :
0,5 0,8 - -
. fin : 0 0,8-0,25 = 0,55 0,25 0,5
. d�but :
0,5 0,25 - -
. fin : 0 0 0,25 0,5
R�action impossible : Aucune transformation n'est observ�e lorsqu'on met les r�actifs en pr�sence.
Au + H2O
R�action �quilibr�e : Dans cette r�action, on observe une transformation, mais aucun des r�actifs ne sera �puis� totalement.
N2 + 3 H2 2 NH3
. d�but :
0,8 0,4 -
. �quilibre : 0,8 - x 0,4 -3x 2x
![]() Le coefficient de x est d�termin� par le coefficient de la mol�cule � laquelle il se
rapporte, lorsque l'�quation est pond�r�e.
Le coefficient de x est d�termin� par le coefficient de la mol�cule � laquelle il se
rapporte, lorsque l'�quation est pond�r�e.
II. Mise en �vidence d'une r�action incompl�te.
  |
Les solutions contenues dans les berlins ci-contre ont la
m�me concentration molaire, (0,1 M).
La solution incolore est une solution de KSCN La solution orang�e/jaune est une solution de FeCl3 |
| Mettons maintenant � l'aide d'une pipette jaug�e la m�me quantit� de r�actifs dans une �prouvette contenant de l'eau distill�e et observons. Nous observons un changement de couleur, ce qui indique qu'une r�action s'est op�r�e. Redistribuons maintenant le contenu de ce berlin dans 3 petits berlins. Dans l'un rajoutons du KSCN, dans un autre, rajoutons du FeCl3 et observons par-rapport au t�moin les changements �ventuels. |
|
 * * |
 * * |
 * * |
| En rajoutant du KSCN, l'on observe que la couleur devient plus intense, il y a donc encore r�action. | En rajoutant du FeCl3, l'on observe que la couleur devient plus intense, il y a donc encore r�action. | Berlin t�moin dans lequel rien n'a �t� rajout�; |
(*) les couleurs ne correspondent pas exactement � la r�alit�.
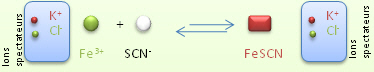
Si lorsque l'on rajoute l'un ou l'autre des deux r�actifs de d�part, la coloration change, c'est qu'il reste encore de l'autre r�actif dans la solution. Ce qui signifie que dans une r�action incompl�te aucun des r�actifs n'est �puis� totalement.
![]() voici comment se note la r�action :
FeCl3 + KSCN
voici comment se note la r�action :
FeCl3 + KSCN ![]() FeSCN2+
+ KCl + 2Cl-
FeSCN2+
+ KCl + 2Cl-
Explication au niveau des mol�cules
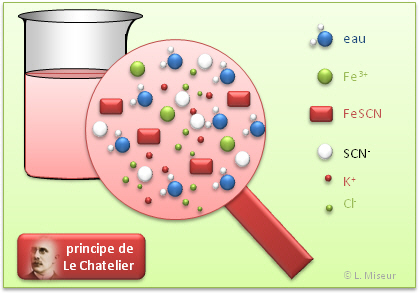
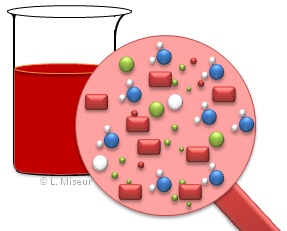
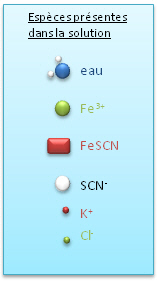
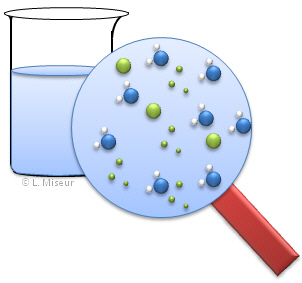
Ce sch�ma repr�sente la composition du berlin t�moin. L'on voit qu'en solution, toutes les esp�ces sont pr�sentes et en �quilibre !
Voyons maintenant ce qu'il se passe dans le berlin lors des diff�rentes additions.
|
|
|
Au d�part, avant l'ajout de KSCN, la solution contient des ions Fe3+, des ions Cl- et des mol�cules d'eau, car nous travaillons avec des solutions aqueuses. |
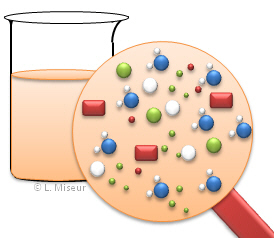
Apr�s addition d'une quantit� x de KSCN, des ions SCN-, K+ et le complexe FeSCN apparaissent dans la solution. La totalit� des ions Fe3+ ne sont pas consomm�s et il reste des ions SCN- qui n'ont pas r�agi dans la solution. |
|
|
|
| Si l'on ajoute une nouvelle quantit� x (au total 2x) de KSCN, l'on observe que la solution devient plus rouge. En fait, des ions Fe3+ et SCN- ont r�agi afin de maintenir les concentrations en SCN- initiales. La formation de KSCN a �t� favoris�e afin de limiter l'apparition d'ions SCN- dans la solution. Tous les r�actifs n'ont pas r�agi et la r�action n'est toujours pas compl�te ! | Dans une r�action �quilibr�e, et dans cette exemple, l'ensemble des ions se retrouve dans des quantit�s d�termin�es dans la solution. Il reste toujours des ions "r�actifs" non consomm�s. |
III. �tat d'�quilibre et r�action incompl�te.
Dans un syst�me chimique � l'�tat d'�quilibre, deux r�actions inverses � vitesse �gale se d�roulent. Ce syst�me chimique est dit alors syst�me � l'�tat d'�quilibre dynamique.
Exemple : dans la r�action d�crite ci-dessus pendant qu'une partie des r�actifs deviennent
FeScN2+ + KCl + 2 Cl-, une autre r�action s'effectue au niveau des produits, ceux-ci redeviennent du FeCl3 + KScN, les deux r�actions se produisent � la m�me vitesse, il nous semble alors que plus aucune r�action ne se fait car il n'y a pas de changement visible � l'�il nu.
Conditions d'�quilibre
- Il faut qu'il n'y ait plus de changement visible � l'�il nu.
- Il faut que le syst�me soit isol�.
- Il faut que 2 r�actions inverses simultan�es se produisent, une r�action directe qui transforme les r�actifs en produits (vert) et une r�action inverse qui transforme les produits en r�actifs (rouge).
IV. Aspect quantitatif de l'�quilibre.
Notations
| une concentration de d�part (initiale) se note : CA = 0,1 mole/L | |
| la concentration � l'�quilibre se note : [ A ] et [A] < 0,1 mole/L |
Loi de Guldberg - Waage
La formule de la constante d'�quilibre a pu �tre mise en �vidence sur base de r�sultats exp�rimentaux.
|
a.A + b.B |
|
| A,B = r�actifs | a,b,c,d : coefficients st�chiom�triques. |
| C,D = produits | |
Kc = notation de la constante d'�quilibre exprim�e en fonction des concentrations.
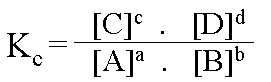
Si Kc est grand ![]() on
tend vers la r�action compl�te.
on
tend vers la r�action compl�te.
Si Kc est tr�s petit ![]() on tend vers une r�action impossible.
on tend vers une r�action impossible.
![]() Dans l'expression de Kc,
on ne fait pas figurer les solides, on remplace les concentrations des solides
par le chiffre [1].
Dans l'expression de Kc,
on ne fait pas figurer les solides, on remplace les concentrations des solides
par le chiffre [1].
Exemple : Expression de la constante d'�quilibre de
2 Li+(aq) + CO32-(aq) ![]() Li2CO3 (s)
Li2CO3 (s)
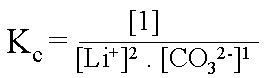
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Equilibre chimique. La Chimie.net. http://www.lachimie.net | |
|
|