Ionisation des atomes
I. Notion d'ion
Un atome �lectriquement neutre est un atome qui poss�de le m�me nombre d'�lectrons que de protons. Des charges ne peuvent appara�tre que si le nombre de protons n'est plus �gal au nombre d'�lectrons. <
Le nombre de protons, contenus dans le noyau ne peut �tre modifi� au cours d'un ph�nom�ne chimique non-nucl�aire. C'est donc par cons�quent les �lectrons qui jouent un grand r�le dans l'ionisation des atomes. Certains atomes ou groupements peuvent gagner ou perdre des �lectrons dans certaines situations.
I.1. D�finition: ion
substance charg�e d'�lectricit� car les charges positives et n�gatives ne se compensent plus compl�tement. Le noyau d'un ion simple est identique � celui de l'atome correspondant ; seul le nuage �lectronique est diff�rent (le nombre d'�lectrons est diff�rent).
II. Ion positif ou cation
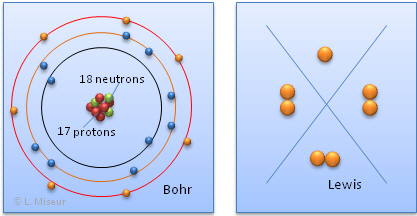
Repr�sentons l'atome de sodium (Na) selon les mod�les de Bohr et de Lewis :
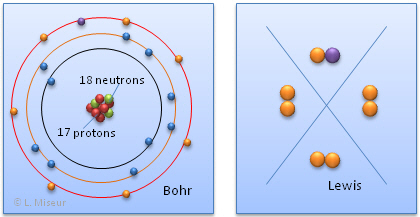
Tentons maintenant de repr�senter l'ion Na+, selon les m�mes mod�les que pr�c�demment.
L'ion Na+ a perdu son seul �lectron de valence, il poss�de maintenant une couche externe compl�te, il a la configuration d'un gaz rare (r�gle de l'octet). On peut repr�senter ce ph�nom�ne sous forme d'une �quation :o:p>
Na ---> Na+ +
1 e-
De mani�re g�n�rale, les
atomes ou groupements m�talliques ont tendance � perdre leur(s) �lectron(s)
pour atteindre la configuration d'un gaz rare.
atome --> ion positif + �lectron(s)
III. Ion n�gatif ou anion
III.1. D�finition
C'est un atome qui est charg� n�gativement car son nombre de protons est inf�rieur � son nombre d'�lectrons.
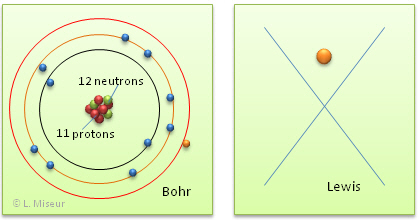
exemple : l'ion
Cl- :
|
forme neutre (Cl) |
|
|
|
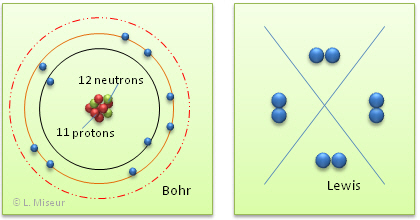
ion Cl- |
|
|
Voici l'�quation d'ionisation : Cl + 1e- --> Cl-
Forme g�n�rale :
atome + �lectron(s) --> ion n�gatif
Note : L'�quation d'ionisation d'un atome est TOUJOURS le nombre d'�lectrons � enlever ou � ajouter pour qu'il obtienne la configuration d'un gaz rare !
Remarque :
Des ions peuvent s'associer afin de former des solides. Ces solides sont alors compos�s d'ions positifs et n�gatifs qui s'attirent et se repoussent et ce jeu d'attraction-r�pulsion conduit � un arrangement particulier des ions en structures solides ordonn�es.
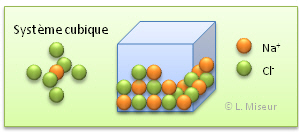
exemple : Le cas du Chlorure de sodium (NaCl)
Compl�ter les �quations d'ionisation des atomes suivants : Ca ---> Cu (I) ---> I ---> Ne --->
D�terminer le nombre de protons, de neutrons et d'�lectrons de chacun de ces ions :
ion Z (nombre de protons)
e-
neutron(s) ?
Mg ++ S2-

R�serv� à une utilisation strictement priv�e-tous droits de reproduction et de diffusion r�serv�s - (c) L. Miseur - La chimie.net 2012
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Ionisation des atomes. La Chimie.net. http://www.lachimie.net | |
|
|