Les ions
I. Les esp�ces charg�es
I.1. Mise en �vidence
Observe les �tiquettes ci-dessous, rep�re les diff�rents �l�ments pr�sents dans cette eau.
Tu auras identifi� plusieurs �l�ments chimiques et symboles d�j� connus ... Mais il y a une diff�rence avec les symboles d�j� vus !
A c�t� des symboles des �l�ments chimiques contenus dans cette eau, appara�t un signe math�matique en exposant (+ ou -). Cela signifie donc que ce ne sont pas les �l�ments neutres qui sont pr�sents dans cette eau, mais des particules charg�es qui ont les m�mes propri�t�s chimiques que les �l�ments neutres. Nous avons d�j� vu que dans un �l�ment chimique, le nombre de protons (particules positives formant le noyau) et le nombre d'�lectrons (particules n�gatives gravitant autour du noyau) est identique. Dans les esp�ces charg�es, les IONS, ces nombres de protons et d'�lectrons sont diff�rents.
/!\ Les ions sont form�s suite � un ajout ou un retrait d'�lectrons ! Les protons sont li�s dans le noyau par des attractions tr�s fortes et lorsque l'on forme un ion, on ne modifie JAMAIS le nombre de protons pr�sents dans le noyau. (Pour rappel, c'est le nombre de protons contenus dans le noyau qui d�termine l'�l�ment !)
I.2. Exp�rience
Nous avons observ� qu'il a donc des esp�ces charg�es dans l'eau. Montrons maintenant que ces ions sont de deux types : soit charg�s positivement (plus de protons que d'�lectrons), soit n�gativement (plus d'�lectrons que de protons).
Pour ce faire, nous allons faire passer un courant �lectrique dans une solution de CuSO4 (sulfate de cuivre) et de K2Cr2O7 (dichromate de potassium).
Dans un tube en U rempli d'une solution conductrice (H2SO4 0,5 mol.L-1), l'on introduit le m�lange d'ions et l'on place ensuite deux �lectrodes de graphite (carbone - comme la mine de ton crayon !). On fait passer un courant �lectrique dans la solution via les �lectrodes (une �lectrode est un mat�riau qui permet le passage du courant). Nous avons donc une �lectrode positive et une n�gative.
- Apr�s 20 minutes, on observe que les ions se sont s�par�s aux deux �lectrodes. L'une montrant une couleur bleue, l'autre orange.
- Il y a donc bien deux types d'ions diff�rents.
II. D�finitions
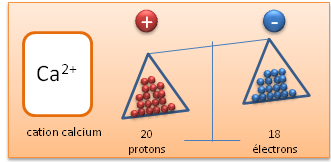
II.1. Cation
Un cation est un ion charg� positivement, ce qui signifie que par-rapport � l'atome neutre, il poss�de moins d'�lectrons.
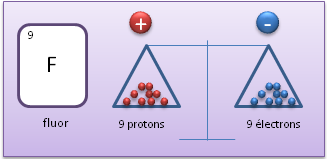
Atome neutre (�l�ment)
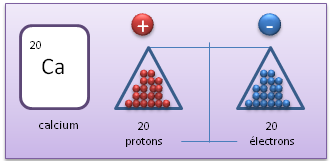
Cation (Calcium avec un d�faut d'�lectrons par-rapport � l'atome neutre)
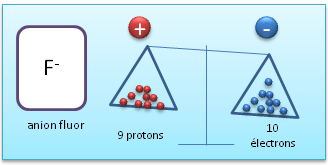
II.2. Anion
Un anion est un ion charg� n�gativement, ce qui signifie que par-rapport � l'atome neutre, il poss�de plus d'�lectrons.
Atome neutre (�l�ment)
Anion (Fluor avec un �lectron en plus par-rapport � l'atome neutre)
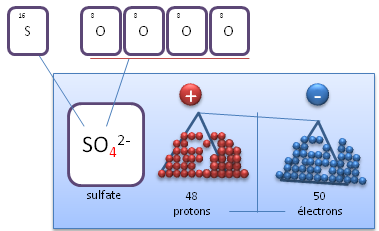
II.3. Ions polyatomiques
Un ion polyatomique est un ion constitu� de plusieurs (poly) atomes. Le nombre de protons correspond � la somme des protons des atomes pr�sents au sein de l'ion polyatomique et sa charge est d�finie par le nombre d'�lectrons total pr�sents. Exemple : l'ion sulfate est charg� 2-, ce qui signifie qu'il poss�de deux �lectrons de plus que le nombre de protons total.
III. Appliquons la th�orie
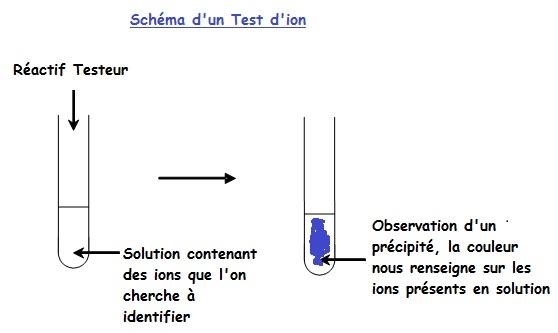
IV. Test d'identification des ions en solution
Il existe des tests de reconnaissance d�ions faisant appel � des r�actions chimiques simples qui donnent des produits solides color�s facilement identifiables dans une solution.
Mode op�ratoire
Introduire dans un tube � essai quelques mL de solution contenant des ions que l'on cherche � identifier.
Dans ce tube, introduire quelques gouttes de r�actif testeur.
Interpr�tation des r�sultats
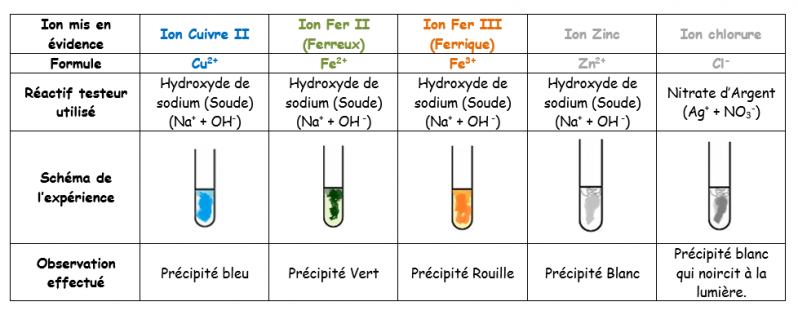
==> Test de reconnaissance des ions Cuivre (Cu2+) : Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Cu2+ forment un précipité bleu.
==> Test de reconnaissance des ions Zinc (Zn2+): Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Zn2+ forment un précipité blanc. Si on met beaucoup de soude, ce précipité se dissout et la solution redevient incolore
==> Test de reconnaissance des ions Fer II (Fe2+): Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Fe2+ forment un précipité vert.
==> Test de reconnaissance des ions Fer III (Fe3+): Réactif utilisé la Soude (Hydroxyde de sodium)
En présence de soude, les ions Fe3+ forment un précipité rouille.
==> Test de reconnaissance des ions Chlorure Cl-: Réactif utilisé le Nitrate d’argent.
En présence de nitrate d’argent, les ions Cl- forment un précipité blanc qui noircit à la lumière.
R�sultats exp�rimentaux
� Labruyere Xavier - Test Identification des ions, [en ligne], http://sciencesphysiques.e-monsite.com/pages/fiches-methodes/test-identification-des-ions.html - Avec son aimable autorisation.
Exercices
![]()
V. Exercices
![]()
![]()
![]()
|
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| ||||||
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Les ions. La Chimie.net. http://www.lachimie.net | |
|
|