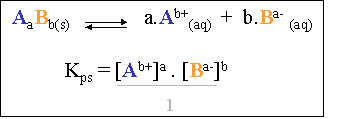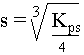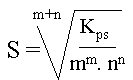La solubilit�
I. Introduction
Que signifie exactement les expressions courantes "ce compos� est soluble, très soluble ou insoluble" en chimie ? La solubilit� d'un compos� peut être d�finie de la fa�on suivante : une quantit� maximale (g ou mole) de solut� dissous dans 1 litre de solution satur�e selon des conditions pr�cises de temp�rature, de nature du solvant et du solut�.
Une solution est satur�e si elle contient une quantit� de solut� �gale (ou sup�rieure) à la solubilit�.
II. Expression de la solubilit�
La solubilit�, not�e "s" s'exprime le plus souvent en g/L ou en mole/L.
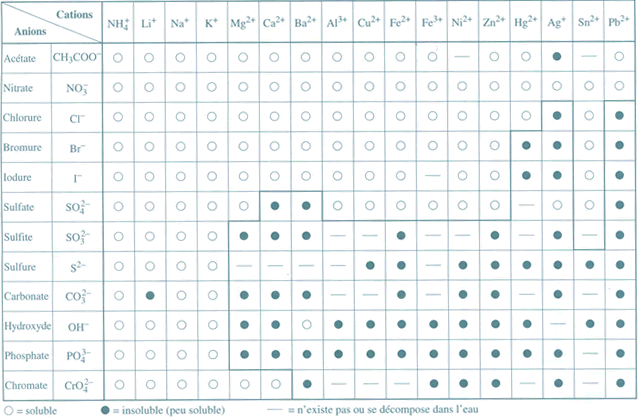
Par convention, un compos� est dit soluble si sa solubilit� est sup�rieure à 0,1 mole par litre de solution
Un compos� sera dit "peu soluble" si sa solubilit� est inf�rieure à 0,1 mole par litre de solution. Le terme "insoluble" sera utilis� pour des compos�s très peu solubles.
III. Tableau qualitatif de la solubilit�
IV. �quilibre dynamique d'une solution satur�e avec excès
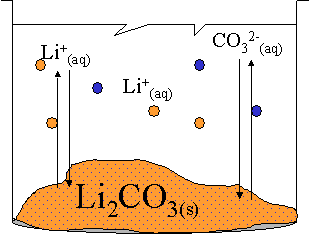 La solution repr�sent�e ci-contre est satur�e avec un excès de solide. Elle constitue un système à l'�tat d'�quilibre. En effet, la temp�rature est constante et l'�vaporation est consid�r�e comme n�gligeable.
La solution repr�sent�e ci-contre est satur�e avec un excès de solide. Elle constitue un système à l'�tat d'�quilibre. En effet, la temp�rature est constante et l'�vaporation est consid�r�e comme n�gligeable.
Comme dans tout système, deux r�actions inverses se produisent simultan�ment : la r�action de dissolution et celle de cristallisation. De plus, la r�action se produit sans que l'on ne puisse en observer les effets directement à l�œil nu.
Il s'agit donc bien d'un système à l'�tat d'�quilibre dynamique, dont l'�quation s'�crira :
![]()
L'on peut g�n�raliser ceci pour toute solution �lectrolyte satur�e avec pr�sence d'un excès.
V. Le produit de solubilit�
Il s'agit d'une constante d'�quilibre comme pour tout système. En appliquant la loi de Guldberg-Waage, l'on obtient une constante d'�quilibre dont l'expression est :
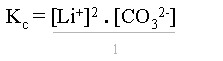 ou
ou ![]()
Les crochets [] signifient la concentration d'ions de Li+, de CO32- ou de tout autre ion se trouvant entre ces crochets.
Cette constante se nomme produit de solubilit� de Li2CO3 et s'�crit : Kps Li2CO3. De nouveau, ceci est valable pour toutes les solutions �lectrolytes satur�es avec excès.
G�n�ralisation
Le d�nominateur n'intervient pas dans le calcul du produit de solubilit� (il est �gal à "1"), car il s'agit d'un solide !
VI. Relation entre la solubilit�, s, et Kps
La table des produits de solubilit� est une liste des constantes obtenues pour diff�rents compos�s à une temp�rature donn�e. ( table des Kps - voir boite � outils ). Le produit de solubilit� permet de retrouver la solubilit� d'un compos�.
Exemple :
Zn(OH)2 (s) Zn2+ (aq) + 2 OH- (aq) rempla�ons le nombre de moles par "s", nous obtenons : s
s + 2s Or, le produit de solubilit� de ce compos� est : Kps = [Zn2+] . [OH-]2 Rempla�ons par "s" : Kps = s . (2s)² Kps = s. 4s² Kps = 4s³ Nous savons, gr�ce à la table des produits de solubilit�, que celui-ci vaut 4,5.10-17 à 25�C pour ce compos�. 4,5. 10-17 = 4s3 s = 2,2 . 10-6 mole/L G�n�ralisation
pour un compos� : AmBn (s)
m.Ax+ (aq) + n.By- (aq), la relation entre le Kps et la solubilit� est :
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Solubilit�. La Chimie.net. http://www.lachimie.net | |
|
|