Mod�le des solutions aqueuses
I. Exp�rience : conductivit� de solutions
| solution | conductivit� (mS) (siemens, S, unit� de mesure de la conductivit�) |
| H2O distill�e | 20 |
| H2O (eau de distribution) | 560 |
| NH3 0,05 M | 325 |
| CH3-COOH 0,05 M | 236 |
| C6H12O6 0,05 M | 43 |
| HCl 0,05 M | 13000 |
| NaCl 0,05 M | 3700 |
Toutes les valeurs dans le tableau ci-dessus ont �t� d�termin�es de mani�re exp�rimentale.
Observations
H2O distill�e n'est pratiquement pas conductrice, car il y a tr�s peu d'ions dans la solution.
NH3, H2O (distribution), CH3-COOH sont faiblement conducteurs, il y a peu d'ions => �lectrolytes faibles.
C6H12O6 m�me comportement que l'eau distill�e, tr�s peu d'ions : non-�lectrolyte.
HCl et NaCl sont fortement conducteurs, il y a donc beaucoup d'ions dans la solution, ce sont des �lectrolytes forts.
D�finition d'�lectrolyte
- substance qui conduit le courant en solution aqueuse.
II. Classement de solutions aqueuses
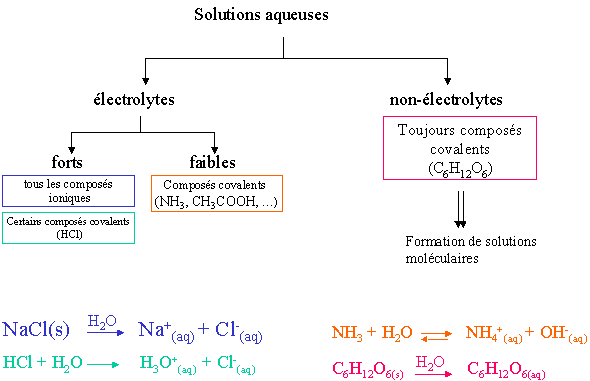
Certains compos�s covalents ( les acides) sont des �lectrolytes. Certains r�agissent totalement avec l'eau, d'autres forment un syst�me � l'�tat d'�quilibre. Un exemple de dissolution dans l'eau pour chacun des diff�rents types de compos� est donn�.
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Mod�le des solutions aqueuses. La Chimie.net. http://www.lachimie.net | |
|
|


