Thermochimie (1) - introduction
I. D�finition de la thermochimie
Etude des changements de chaleur accompagnant les r�actions chimiques. Cette chaleur est soit absorb�e, soit d�gag�e.
II. Transfert de chaleur
Echange entre le milieu ext�rieur et le m�lange en r�action.
-
Ph�nom�ne exothermique
- D�finition : Ph�nom�ne produisant de l'�nergie thermique (d�gagement de chaleur)
| exemples : 1. | Ca + 2 H2O --> Ca(OH)2 + H2 + E |
| 2. | NaOH (s) |
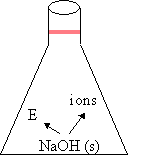
| NaOH (s) |
| Hr Hp |
- Enthalpie = contenu �nerg�tique d'une substance, se note H.
Pour savoir si une r�action sera exothermique ou endothermique, il faut calculer la diff�rence d'enthalpie. Celle-ci se calcule en faisant la diff�rence entre l'enthalpie des produits (Hp) et l'enthalpie des r�actifs (Hr). Si la diff�rence d'enthalpie, not�e : ΔH, est n�gative, la r�action sera exothermique. ΔH < 0.
Voici le diagramme d'enthalpie d'une r�action exothermique :
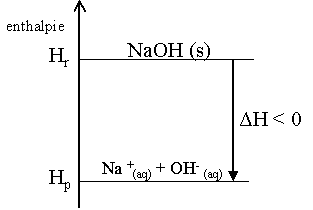
-
Ph�nom�ne endothermique
- D�finition : Ph�nom�ne qui absorbe de l'�nergie.
| exemple : 1. | KNO3 (s) + �nergie --> K+ (aq) + NO3 - (aq) |
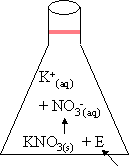 Une r�action est
endothermique, si la diff�rence d'enthalpie entre les produits (Hp)
et les r�actifs (Hr) est positive.
Une r�action est
endothermique, si la diff�rence d'enthalpie entre les produits (Hp)
et les r�actifs (Hr) est positive.
ΔH > 0
Diagramme enthalpie d'une r�action endothermique :
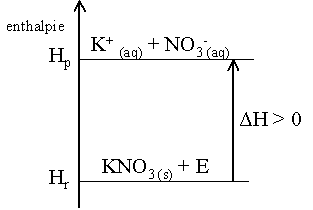
Remarque :
Chaleur et temp�rature sont des notions diff�rentes souvent confondues !! La temp�rature ne d�pend pas de la quantit� de mati�re. A l'inverse, la chaleur d�pend de la quantit� de mati�re. La chaleur est une propri�t� extensive et la temp�rature est une propri�t� intensive (dont l'intensit� ne change pas avec la quantit�).
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Thermochimie (1). La Chimie.net. http://www.lachimie.net | |
|
|


