pH de solutions aqueuses
I. Les diff�rents types de solutions acido-basiques
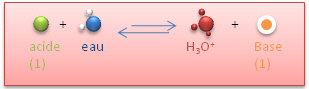
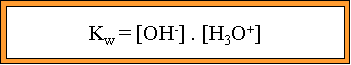
Rappels

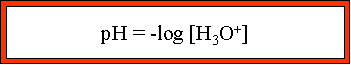
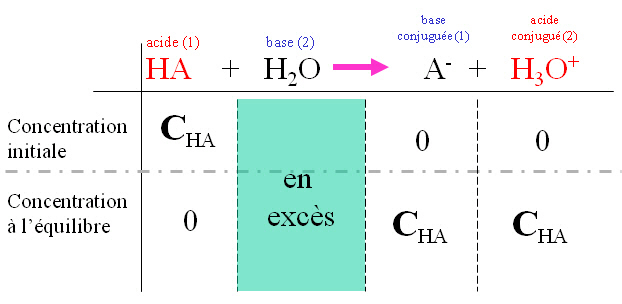
II. Acide fort : Un acide fort est totalement dissoci�
pH = - log [H3O+] --> ![]() ; CHa, �tant la
concentration initiale d'acide exprim�e
en mol.L-1 ou molaire.
; CHa, �tant la
concentration initiale d'acide exprim�e
en mol.L-1 ou molaire.
III. Base forte : Une base forte est totalement dissoci�e
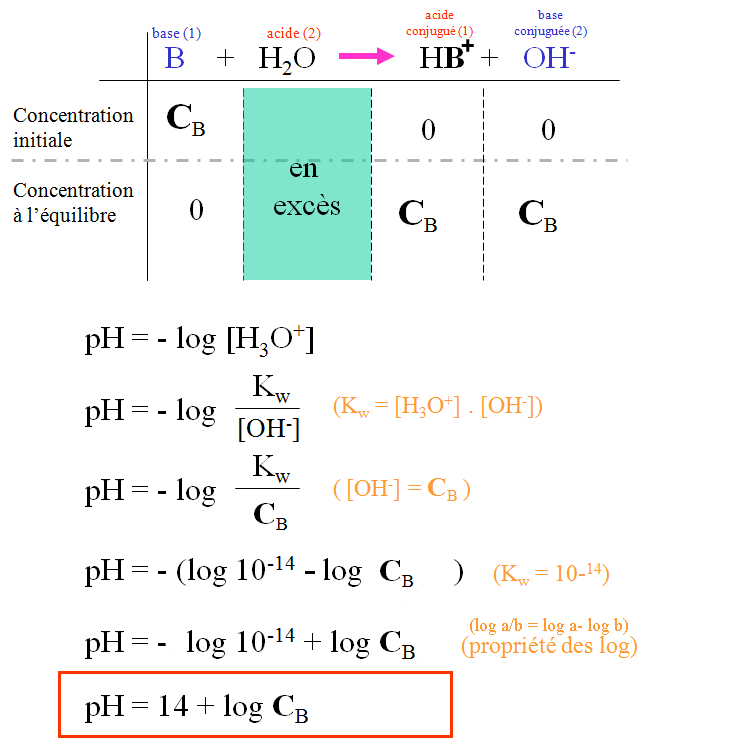
IV. Acide faible : un acide faible est partiellement dissoci�

V. Base faible : une base faible plac�e en solution aqueuse
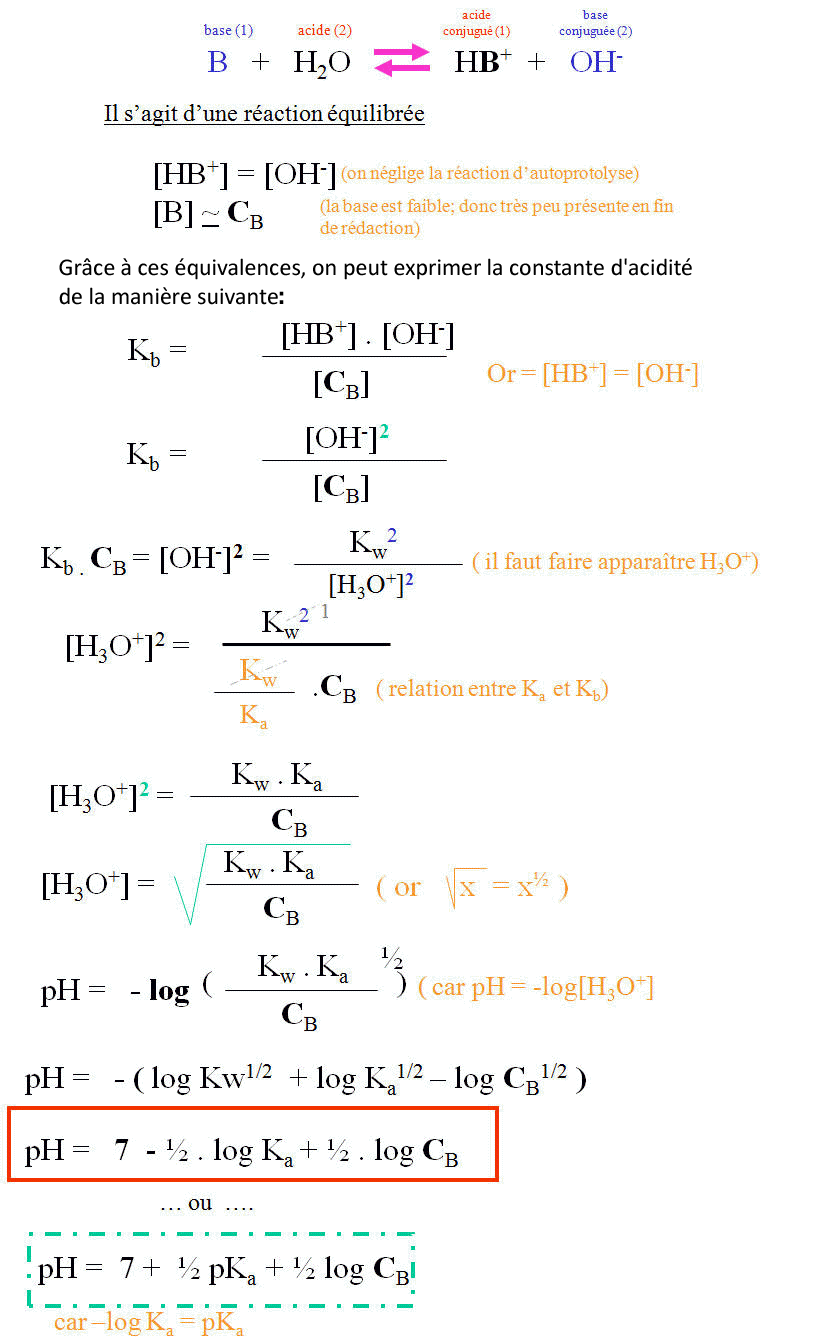
VI. M�lange Tampon : Solution d'un acide faible et de sa base conjugu�e

![]() Si la
solution est compos�e d'une base faible et de son acide conjugu� ou d'un acide
faible et de sa base conjugu�e, on parlera de
m�lange tampon. Ce m�lange aura comme caract�ristique de garder un pH très
stable. Ce type de solution est utilis� pour �talonner les pH-mètres.
Si la
solution est compos�e d'une base faible et de son acide conjugu� ou d'un acide
faible et de sa base conjugu�e, on parlera de
m�lange tampon. Ce m�lange aura comme caract�ristique de garder un pH très
stable. Ce type de solution est utilis� pour �talonner les pH-mètres.
-
Un m�lange tampon auquel j'additionne du chlorure d'hydrogène (HCl) ou de l'hydroxyde de sodium (NaOH) va garder un pH très stable. La variation de pH pour de petits ajouts sera très faible alors qu'un même ajout dans de l'eau distill�e provoquerait des �carts de pH de plus de 4 unit�s (soit 10.000 fois plus !).
Composition d'un m�lange tampon : Acide / base conjugu�e
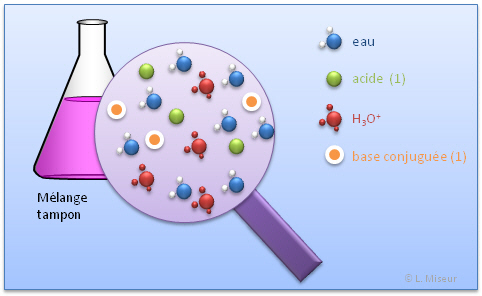
Dans un m�lange tampon, l'on retrouve : l'eau, l'acide, sa base conjugu�e et H3O+.
Ces diff�rentes espèces sont en �quilibres dans la solutions.
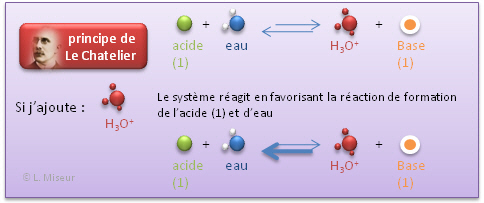
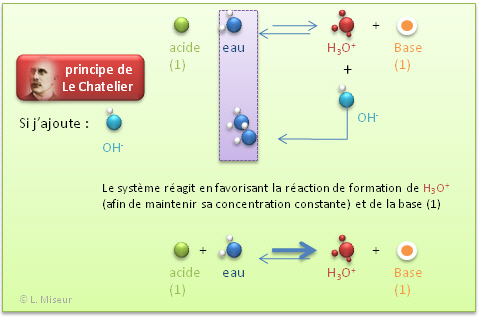
Que se passe-t-il lorsque je modifie l'�quilibre?
- Par ajout d'un acide fort (HCl)
- Par ajout d'une base forte (NaOH)
Nous voyons donc que ces faibles variations de pH (qui sont donc de faibles variations de la concentration en ions H3O+) peuvent être expliqu�e sur base du principe de Le Chatelier.
Ces m�langes ont toutefois une limite ! Pour l'ajout de trop grande quantit� de base ou d'acide, l'une des deux espèces du couple acide-base pourrait se retrouver totalement consomm�e et dans ce cas, la r�action deviendrait trop favoris�e dans un sens et même complète.
Le pH d'une solution tampon compos�e de concentrations identiques en base et en acide vaut exactement la valeur du pKa (-log(Ka)) du couple.

Comment r�aliser des m�langes tampon ?
Par l'ajout d'une même quantit� de base et d'acide (du même couple !)
Par la neutralisation partielle de l'acide du couple par une base forte (la neutralisation par une base forte fera apparaitre la base conjugu�e de l'acide)
Par la neutralisation partielle de la base du couple par un acide fort (la neutralisation par un acide fort de la base conjugu�e du couple fera apparaitre l'acide)
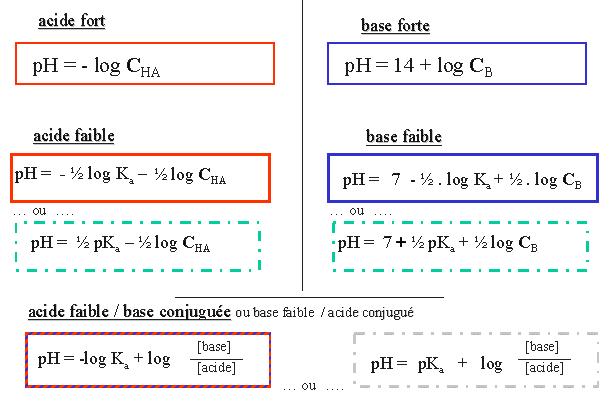
VII. Synth�se des formules de calcul de pH
VII.Exercices
![]()

- Relations pH, pOh, concentrations
- Association d'espèces conjugu�es
- Equations acide-base à compl�ter
- Calcul de pH et concentrations
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - pH de solutions aqueuses. La Chimie.net. http://www.lachimie.net | |
|
|