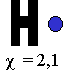Les liaisons chimiques
Les atomes s'assemblent en mol´┐Żcule en mettant en commun ou en c´┐Żdant des ´┐Żlectrons. Le but ´┐Żtant que la mol´┐Żcule soit plus stable que chaque atome isol´┐Ż. Ainsi, dans certains cas, des ´┐Żlectrons seront c´┐Żd´┐Żs d'un atome ´┐Ż un autre afin que chacun des deux atomes atteigne un ´┐Żtat stable.
Dans certains cas, l'attraction r´┐Żciproque entre des atomes, la liaison entre eux, se justifiera par le fait qu'ils sont charg´┐Żs de signes contraires (+/-). Il peut y avoir des liaisons bas´┐Żes sur la simple attraction ´┐Żlectrostatique (Forces de Coulomb) ou bas´┐Że sur le partage d'´┐Żlectron de fa´┐Żon ´┐Żquitable ou pas entre les atomes.
I. Les diff´┐Żrentes unions entre atomes ou "comment les atomes s'unissent-ils" ?
I.1. Liaison covalente normale parfaite ( CNP )
Exemple : la mol´┐Żcule d' H2 (dihydrog´┐Żne) : chaque atome est constitu´┐Ż d'un proton (+) autour duquel gravite un ´┐Żlectron (-). Il y a une force d'attraction qui s'exerce entre le proton et l'´┐Żlectron appartenant au
m´┐Żme atome. Ces m´┐Żmes ´┐Żl´┐Żments ´┐Żtant attir´┐Żs ´┐Żgalement par ceux de l'atome voisin.
(!) Chaque atome d'hydrog´┐Żne est ´┐Żlectriquement neutre. Pourtant, ils sont compos´┐Żs de charges positives et n´┐Żgatives. Gr´┐Żce ´┐Ż la pr´┐Żsence des ´┐Żlectrons, il est possible de combiner les charges afin de former une mol´┐Żcule ´┐Żlectriquement neutre ´┐Żgalement (!)
Chacun des ´┐Żlectrons est attir´┐Ż par les deux noyaux, mais en m´┐Żme temps, des forces de r´┐Żpulsion s'exercent entre les ´┐Żl´┐Żments charg´┐Żs identiquement (les noyaux se repoussent et les ´┐Żlectrons se repoussent). Cela signifie que les deux atomes se rapprocheront jusqu'´┐Ż une certaine distance. Cette distance ´┐Żtant le lieu o´┐Ż forces de r´┐Żpulsions et d'attractions sont ´┐Żgales. Il faut rappeler que les ´┐Żlectrons et la liaison ne sont pas fig´┐Żs. Il s'agit d'un syst´┐Żme dynamique (en mouvement). Ainsi, en moyenne, les ´┐Żlectrons dans la mol´┐Żcule de dihydrog´┐Żne ( H2 ) se trouvent entre les deux noyaux d'hydrog´┐Żne.
Repr´┐Żsentons la m´┐Żme chose mais avec le mod´┐Żle de Lewis :
| soit :
|
Les deux ´┐Żlectrons sont mis en
communs et perdent leur appartenance ´┐Ż l'un ou ´┐Ż l'autre atome. Ils sont
mis en communaut´┐Ż. Ces deux ´┐Żlectrons forment une paire ´┐Żlectronique. D´┐Żs
lors, chaque atome de H est entour´┐Ż de deux ´┐Żlectrons et a atteint la
configuration plus stable de L'H´┐Żlium.
Cette mise en commun est appel´┐Że liaison covalente ou covalence. |
||
| atome d'hydrog´┐Żne | atome d'hydrog´┐Żne |
Chaque ´┐Żl´┐Żment va avoir tendance ´┐Ż essayer d'obtenir la configuration ´┐Żlectronique du Gaz rare le plus proche.
Dans le cas ci-dessus, il s'agit d'une mise en commun entre atomes identiques. Cette mise en commun sera appel´┐Że Liaison covalente normale parfaite (CNP). La mol´┐Żcule ´┐Żtant parfaitement sym´┐Żtrique tant du point de vue des atomes que des ´┐Żlectrons.
La repr´┐Żsentation : Il s'agit de celle de Lewis l´┐Żg´┐Żrement modifi´┐Że. L'on repr´┐Żsente d'abord chaque atome par son symbole entour´┐Ż de ces signes (paires ou ´┐Żlectrons), ensuite, on ´┐Żtablit les paires entres les ´┐Żlectrons des deux atomes. Exemple ci-dessous :
| H2 | soit : |
|
ce qui donne: |
|
I.2. Liaison covalente normale polaris´┐Że (CNpol.)
a. ´┐Żlectron´┐Żgativit´┐Ż
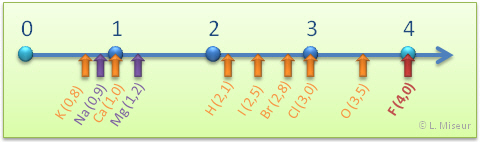
L'´┐Żlectron´┐Żgativit´┐Ż d'un ´┐Żl´┐Żment d´┐Żsigne la force d'attraction que cet ´┐Żl´┐Żment exerce sur les ´┐Żlectrons d'une liaison. L'´┐Żl´┐Żment le plus ´┐Żlectron´┐Żgatif est le Fluor (4) et le moins ´┐Żlectron´┐Żgatif est le C´┐Żsium (0,7). L'´┐Żlectron´┐Żgativit´┐Ż des autres ´┐Żl´┐Żments varie entre ces deux mesures. L'´┐Żlectron´┐Żgativit´┐Ż augmente de gauche ´┐Ż droite dans une p´┐Żriode et de bas en haut dans une m´┐Żme famille. L'´┐Żlectron´┐Żgativit´┐Ż par le symbole c.
C'est le chimiste et physicien am´┐Żricain Linus Pauling qui a d´┐Żtermin´┐Ż de fa´┐Żon arbitraire, (il a fait un choix), l'´┐Żchelle d'´┐Żlectron´┐Żgativit´┐Ż.
Il a attribu´┐Ż la valeur "4" au Fluor et par comparaison a attribu´┐Ż des valeurs aux autres ´┐Żl´┐Żments.

La diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż Δc entre deux ´┐Żl´┐Żments s'obtient en faisant la diff´┐Żrence entre la plus grande valeur d'´┐Żlectron´┐Żgativit´┐Ż et la plus basse.
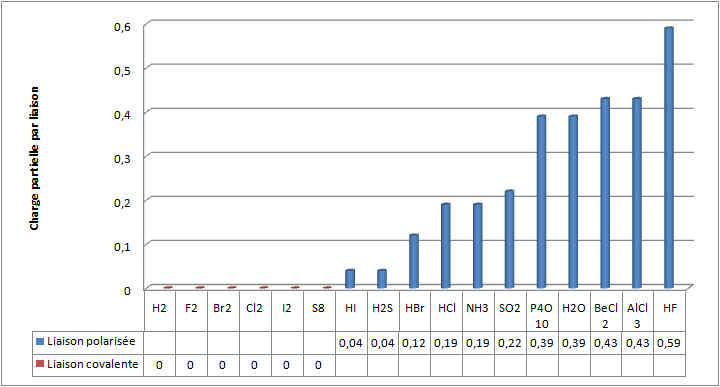
Les ´┐Żl´┐Żments dont la liaison est covalente normale polaris´┐Że ne portent pas des charges ´┐Żlectriques enti´┐Żres. En effet, l'´┐Żlectron bien qu'´┐Żtant plus attir´┐Ż par l'un des atomes est toujours pr´┐Żsent au c´┐Żt´┐Ż de l'autre atome ´┐Żgalement. Ils mettent chacun en commun un ´┐Żlectron c´┐Żlibataire. Cependant, si la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż est inf´┐Żrieure ou ´┐Żgale ´┐Ż 1,5. Les ´┐Żlectrons n'appartiendront pas ´┐Ż un ´┐Żl´┐Żment sp´┐Żcifique. Ils seront juste plus souvent pr´┐Żs de l'´┐Żl´┐Żment le plus ´┐Żlectron´┐Żgatif (en moyenne - n'oublions pas que c'est un mod´┐Żle dynamique en mouvement au cours du temps !).
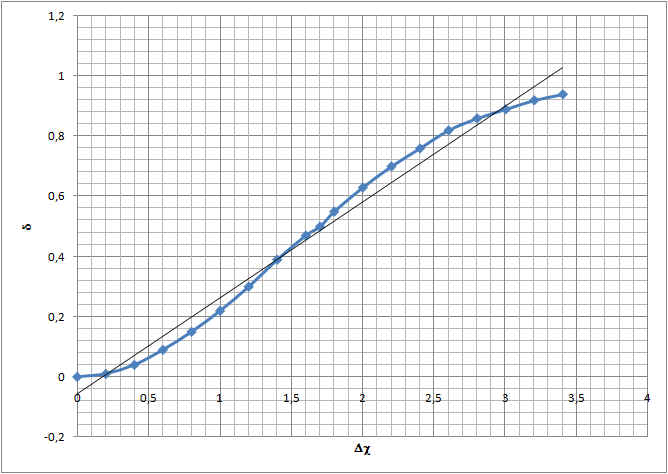
Chaque ´┐Żl´┐Żment sera charg´┐Ż avec une charge partielle. Observez le graphique ci-dessous faisant le lien entre la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż et la charge partielle port´┐Że par les atomes.
|
|
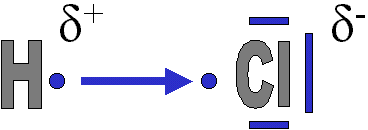
b. D´┐Żmonstration avec la mol´┐Żcule d'HCl
1. Repr´┐Żsentation des atomes sous forme du mod´┐Żle de Lewis |
|
|
|
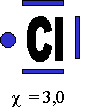 |
2. Calcul de la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż des ´┐Żl´┐Żments |
|
| |
|
3. Repr´┐Żsentation de la liaison en sachant que l'´┐Żlectron sera statistiquement plus souvent pr´┐Żsent pr´┐Żs de l'´┐Żl´┐Żment le plus ´┐Żlectron´┐Żgatif, celui-ci devenant donc partiellement n´┐Żgatif (1 ´┐Żlectron en plus, la plupart du temps, mais pas tout le temps !), l'autre ´┐Żl´┐Żment devenant partiellement positif (un ´┐Żlectron en moins). La fl´┐Żche indique qu'il s'agit d'un d´┐Żplacement de l'´┐Żlectron et non du d´┐Żpart de l'´┐Żlectron. La fl´┐Żche indique donc l'´┐Żl´┐Żment le plus ´┐Żlectron´┐Żgatif. |
|
|
|
|
|
|
|
Une liaison covalente normale polaris´┐Że est donc une mise en commun d'un ou plusieurs ´┐Żlectrons c´┐Żlibataires entre atomes d'´┐Żlectron´┐Żgativit´┐Ż peu diff´┐Żrente (Δc ≤ 1,5). Au del´┐Ż, l'´┐Żlectron va ´┐Żtre attir´┐Ż si fort par l'atome le plus ´┐Żlectron´┐Żgatif, qu'ils vont ou va lui ´┐Żtre donn´┐Ż par l'autre atome !
Simulation : polarit´┐Ż des mol´┐Żcules
d. Quelques exemples avec des mol´┐Żcules courantes.
I.3. La Liaison ionique
Lorsque la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż est sup´┐Żrieure ´┐Ż 2, les forces en pr´┐Żsence s'exer´┐Żant sur les ´┐Żlectrons de l'´┐Żl´┐Żment le moins ´┐Żlectron´┐Żgatif sont suffisantes pour lui arracher d´┐Żfinitivement un ou plusieurs ´┐Żlectrons. Il ne s'agit donc plus d'une mise en commun, mais d'un don.
Les charges seront donc compl´┐Żtes, l'´┐Żl´┐Żment le moins ´┐Żlectron´┐Żgatif perd un ou plusieurs ´┐Żlectrons et devient donc un ion positif (cation) et l'´┐Żl´┐Żment le plus ´┐Żlectron´┐Żgatif re´┐Żoit un ou plusieurs ´┐Żlectrons et devient donc un ion n´┐Żgatif (anion).
Les interactions entres ces ´┐Żl´┐Żments sont alors des interactions d'ordre ´┐Żlectrostatique (Force de Coulomb).
Repr´┐Żsentation avec une mol´┐Żcule de NaCl
|
1. Repr´┐Żsentation sous forme du mod´┐Żle de Lewis des ´┐Żl´┐Żments composant la mol´┐Żcule |
2. Calcul de la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż |
3. La diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż est telle que l'´┐Żl´┐Żment le moins ´┐Żlectron´┐Żgatif c´┐Żde un de ses ´┐Żlectrons ´┐Ż l'´┐Żl´┐Żment le plus ´┐Żlectron´┐Żgatif. Le premier devient positif (+ 1 proton et le deuxi´┐Żme devient n´┐Żgatif ( + 1 ´┐Żlectron). |
 |
Na (c = 0,9) et Cl (c = 3) | |
| -> (3 - 0,9) = 2,1 |
|
|
| -> Δc = 2,1 > 2 | ||
| -> ionique | ||
D´┐Żfinition
Une liaison ionique r´┐Żsulte d'une attraction entre ions form´┐Żs par transfert d'´┐Żlectrons entre atomes d'´┐Żlectron´┐Żgativit´┐Żs tr´┐Żs diff´┐Żrentes (Δc> 2) de l'atome le moins ´┐Żlectron´┐Żgatif vers l'atome le plus ´┐Żlectron´┐Żgatif.
![]() Pour les cas o´┐Ż la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż est comprise entre 1,6 et 2, et, si aucune autre indication n'est ajout´┐Że ´┐Ż l'´┐Żnonc´┐Ż, seul l'exp´┐Żrimentation pourra montrer s'il s'agit d'une liaison covalente normale polaris´┐Że ou d'une liaison ionique. Pour ces cas l´┐Ż, les deux r´┐Żponses seront donc accept´┐Żes dans l'´┐Żtat actuel
de nos connaissances.
Pour les cas o´┐Ż la diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż est comprise entre 1,6 et 2, et, si aucune autre indication n'est ajout´┐Że ´┐Ż l'´┐Żnonc´┐Ż, seul l'exp´┐Żrimentation pourra montrer s'il s'agit d'une liaison covalente normale polaris´┐Że ou d'une liaison ionique. Pour ces cas l´┐Ż, les deux r´┐Żponses seront donc accept´┐Żes dans l'´┐Żtat actuel
de nos connaissances.
La liaison ionique n'est pas orient´┐Że. Il s'agit d'interactions ´┐Żlectrostatiques entre des entit´┐Żs charg´┐Żes de signes oppos´┐Żs. Voyons comme illustration la structure d'un cristal de sel de cuisine (NaCl). Il est impossible d'isoler une mol´┐Żcule "NaCl".
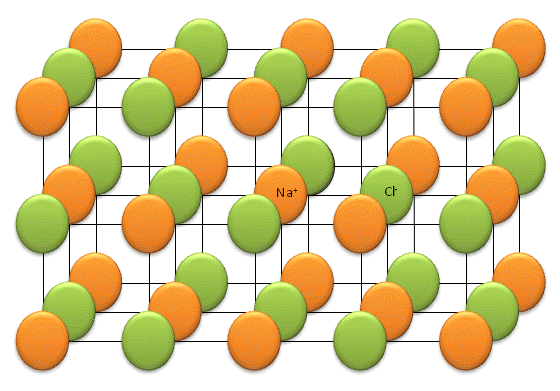
Un ion Na+ est attir´┐Ż plusieurs ions Cl- et un ion Cl- est attir´┐Ż par plusieurs ions Na+. Les ions Cl- se repoussent entre eux et les ions Na+ se repoussent entre eux. L'association des forces d'attractions et de r´┐Żpulsions permet d'arriver au r´┐Żsultat suivant : chaque cation est directement entour´┐Ż d'anions et chaque anion est directement entour´┐Ż de cations.
I.4. synth´┐Żse
Dans la mol´┐Żcule H2, l'attraction entre les deux noyaux est assur´┐Że par une paire d'´┐Żlectrons situ´┐Żs entre eux. Cette paire d'´┐Żlectrons est responsable de la liaison entre les deux noyaux.
Dans le cristal NaCl, la liaison est assur´┐Że par des interactions ´┐Żlectrostatiques entre les ions et non plus par une paire d'´┐Żlectrons liants comme dans H2 , Cl2 ...
La liaison chimique peut rev´┐Żtir deux aspects contrast´┐Żs:
Une liaison assur´┐Że par la mise en commun d'une paire d'´┐Żlectrons liants: LIAISON COVALENTE si les ´┐Żlectrons sont attir´┐Żs par la m´┐Żme ´┐Żlectron´┐Żgativit´┐Ż par chacun des atomes, LIAISON COVALENTE POLARISEE, s'il existe une diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż inf´┐Żrieure ou ´┐Żgale ´┐Ż 1,5 entre les atomes.
Une liaison assur´┐Że par l'attraction ´┐Żlectrostatique entre ions de signes oppos´┐Żs : LIAISON IONIQUE.
cas liaison
- entre deux ´┐Żl´┐Żments identiques (ex : H2)
liaison covalente normale parfaite
- diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż inf´┐Żrieure ou ´┐Żgale ´┐Ż 1,5 (Δc ≤ 1,5).
liaison covalente normale polaris´┐Że
- diff´┐Żrence d'´┐Żlectron´┐Żgativit´┐Ż sup´┐Żrieure ´┐Ż 2 (Δc > 2)
liaison ionique (*) Il existe cependant certaines exceptions ´┐Ż ces r´┐Żgles.
Lorsqu'il y a plus de deux ´┐Żl´┐Żments intervenant dans la mol´┐Żcule, il peut ´┐Żtre difficile de repr´┐Żsenter leur liaison (formule de structure). Avant de se lancer dans les exercices, quelques infos ´┐Ż savoir :
1. Les liaisons entre O sont ´┐Ż ´┐Żviter, car peu stables. 2. Les liaisons entre O et H se forment tr´┐Żs facilement 3. La liaison ionique est utilis´┐Że si un des atomes de la mol´┐Żcule ne r´┐Żalise pas l'octet. Elle se rencontrera dans les mol´┐Żcules contenant un m´┐Żtal. 4. Les liaisons entre C (carbone) se font tr´┐Żs facilement, ils peuvent ´┐Żtre unis de fa´┐Żon simple, double voire triple. 5. Dans certains cas, la combinaison de deux types de liaison peut ´┐Żtre possible. ( ex : liaison ionique et covalente dans la mol´┐Żcule de HNO2).

Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r´┐Żserv´┐Żs | remis ´┐Ż jour le : 21/10/2020
Comment citer cette page : Miseur, L. (2020). Lachimie.net - Liaisons chimiques. La Chimie.net. http://www.lachimie.net