Stabilit� atomique
I. Rayon atomique
I.1. D�finition :
Les nuages �lectroniques contenant les �lectrons n'ont pas de limites pr�cises, mais lorsque les atomes sont rapproch�s les uns contre les autres dans des solides ou dans des mol�cules, le centre de ces deux atomes sont s�par�s par une distance bien d�finie. Il s'agit du rayon atomique. Ce rayon est la distance qui s�pare les centres de deux atomes contigus. Cette distance vaut donc 2r.
Variation du rayon atomique :
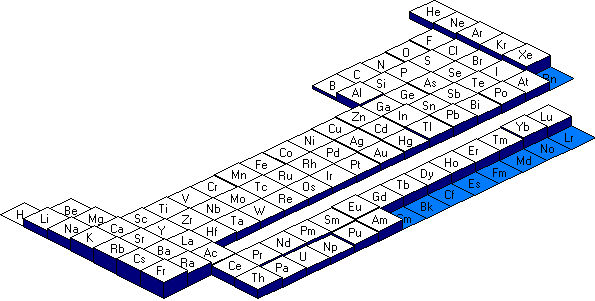
Nous pouvons constater que dans une m�me p�riode, le rayon diminue de gauche � droite et dans une m�me famille le rayon augmente de haut en bas.
II. �nergie d'ionisation
II.1. D�finition
C'est la quantit� d'�nergie n�cessaire pour enlever un ou plusieurs �lectrons � un atome. Cette �nergie � fournir n'est pas identique pour chaque �l�ment et augmente lorsque l'on enl�ve plusieurs �lectrons. L'�nergie d'ionisation n�cessaire � l'arrachement d'un premier �lectron sera plus petite que celle � fournir pour enlever le deuxi�me �lectron et ainsi de suite.
II.2. Graphique montrant les variations de l'�nergie d'ionisation selon les �l�ments :
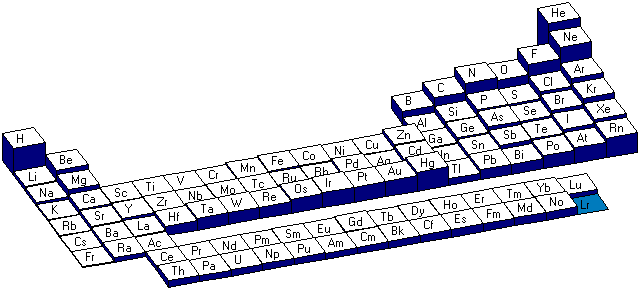
L'analyse des deux graphiques nous d�montre que l'�nergie de premi�re ionisation (Ei1) diminue lorsque le rayon atomique augmente. Cette variation est due au fait qu'un �lectron plus proche du noyau subit plus la force d'attraction de celui-ci. Plus le rayon atomique est petit, plus il faudra apporter de l'�nergie pour arracher un �lectron � l'atome.
III. R�gle de l'octet
Les deux graphiques qui suivent nous montrent qu'il est possible de poursuivre l'ionisation des atomes afin d'un retirer des �lectrons. L' �nergie fournie pour la deuxi�me ionisation (enl�vement d'un deuxi�me �lectron) sera appel�e �nergie de deuxi�me ionisation, pour enlever le troisi�me �lectron, il y aura �galement besoin d'un apport �nerg�tique appel� �nergie de troisi�me ionisation, ...
| soit : | |
| Atome + Ei1 ---> A+ + 1e- | |
| A+ + Ei2 ---> A++ + 1e- | |
| A++ + Ei3 ---> A+++ + 1e- | , ... |
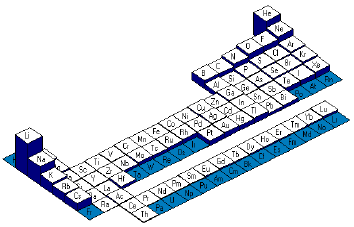 graphique des �nergies de
deuxi�me ionisation (Ei2)
graphique des �nergies de
deuxi�me ionisation (Ei2)
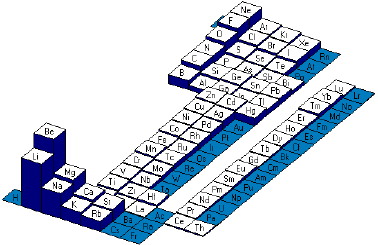 graphique des �nergies de
troisi�me ionisation (Ei3)
graphique des �nergies de
troisi�me ionisation (Ei3)
Nous constatons que des hausses brutales apparaissent dans ces graphes. Ce ph�nom�ne est d� au fait que lorsqu'un atome arrive � la m�me configuration �lectronique qu'un gaz rare (8 �lectrons dans sur la couche �lectronique ext�rieure), L'atome est plus stable. Cette r�gle est appel�e r�gle de l'octet.
IV. Affinit� �lectronique
L'affinit� �lectronique, not�e Ee, d�signe la quantit� d'�nergie lib�r�e lorsqu'un atome neutre (�lectriquement) capte un �lectron pour se transformer en ion n�gatif.
Par d�finition : X(g) + 1e- → X-(g)
Les halog�nes ont la plus grande affinit� �lectronique. Ces �l�ments qui poss�dent 7 �lectrons sur leur couche externe, et dont la seule addition d'un �lectron leur permet d'atteindre la configuration d'un gaz rare ont tendance � "prendre" un �lectron � un autre atome. A l'inverse, Les m�taux ne poss�de que 2 ou 3 �lectrons sur leur couche externe et ont plut�t tendance � c�der leurs �lectrons � des �l�ments plus �lectron�gatifs.
Retenons la r�gle de l'octet : Un atome poss�dant 8 �lectrons dans sa couche �lectronique externe est plus stable qu'un autre.
|
|
 |
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - Stabilit� atomique. La Chimie.net. http://www.lachimie.net | |
|
|


