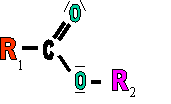Les
esters
I. formation
Un ester r�sulte de la r�action d'un acide carboxylique et d'un alcool.
L�acide carboxylique perd lors de cette r�action sont groupement |OH| et
l'alcool va perdre un hydrog�ne |H|, la combinaison de ces �l�ments
"perdus" formera de l'eau. Donc, un acide et un alcool r�agissent
ensemble pour former un ester et de l'eau.
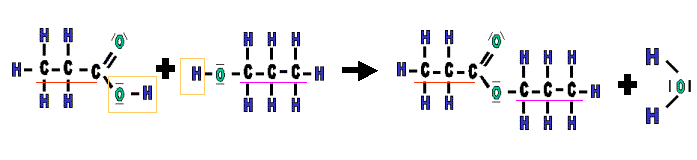
La cha�ne carbon�e de l'alcool d�barrass�e de son atome d'hydrog�ne,
vient prendre la place du groupement OH sur la mol�cule d'acide.
II. formule g�n�rale
|
|
R1 d�signant une premi�re cha�ne carbon�e issue d'un acide carboxylique et R2 �tant la cha�ne carbon�e de l'alcool qui s'est "ajout�e" � l'acide en formant cet ester et de l'eau. |
III. Nomenclature
La nomenclature des esters est compos�e de deux termes, le premier
terminant en -oate d�signant la cha�ne carbon�e issue de l'acide et le deuxi�me
terminant par -yle d�signant la cha�ne carbon�e de l'alcool.
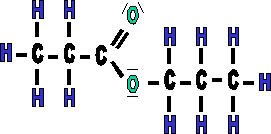 |
1. D�terminer la longueur de la cha�ne provenant de l'acide, ici 3 donc propan- et rajout� le suffixe OATE : ---> propanoate |
| 2. Ajouter un "de" apr�s le nom en -oate | |
| 3. D�terminer la longueur de cha�ne provenant de l'alcool, ici 3, donc prop, puis terminer par le suffixe -YLE (avec le "e" car en fin de nom.) | |
| 4. Ce qui donne propanoate de propyle |
![]() Pour les compos�s avec ramifications : exemple :
Pour les compos�s avec ramifications : exemple :
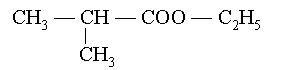 |
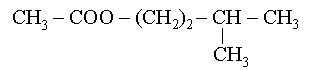 |
||
|
2-m�thylpropanoate d��thyle |
|
IV. Propri�t�s
IV.1. Odeurs
Beaucoup d'esters ont des odeurs caract�ristiques et sont la base de parfums artificiels :| Nom du compos� | odeurs |
| �thanoate d'�thyle | Dissolvant |
| �thanoate d'hexyle | poires |
| Butanoate d'�thyle | ananas |
| �thanoate d'octyle | oranges |
| Butanoate de m�thyle | pommes |
| Butanoate de pentyle | abricots |
| ... |
... |
IV.2. r�action d'hydrolyse
Un ester de formule g�n�rale R-COOR' + H2O donnera deux compos�s : R-COOH et R'-OH . On peut donc cr�er un ester � partir d'un alcool et d'un acide, mais l'on peut �galement r�cup�rer un alcool et un acide d'un ester + H2O.
IV.3. r�action de saponification
Il s'agit de la r�action d'un ester avec une solution de soude (NaOH)
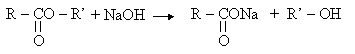
Cette r�action appliqu�e aux esters particuliers, appel�s corps gras permet de fabriquer les savons.
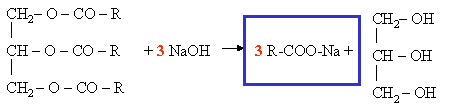
Formule g�n�rale d'un savon : R-COONa.
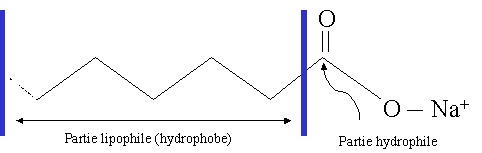
Les savons :
Un savon est constitu� de deux parties : une partie polaire hydrophyle (la t�te) et une partie non-polaire hydrophobe mais lipophile (qui aime les lipides), ( la cha�ne carbon�e).
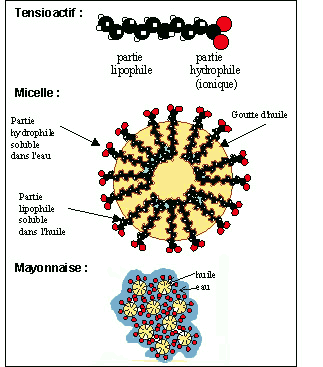
Les mol�cules de savons s'ionisent au contact de l'eau (H2O). Elles se fixent alors sur les graisses ou les huiles.
La partie lipophile va s'orienter vers les mol�cules d'huile ou de graisse, tandis que la partie hydrophile s'orientera vers les mol�cules d'eau.
(C) http://www.ac-montpellier.fr/scphysiques/ | Avec leur aimable autorisation.
Les t�tes polaires vont se repousser, car �tant charg�es de plus en plus et il va alors se former une micelle, celle-ci polaire ext�rieurement va rester dans l'eau. Les micelles �tant toutes charg�es de m�me signe se repousseront l'une l'autre �vitant la reformation d'un amas de graisses/huiles.
|
Copyright (c) 2000 - 2020 | Miseur Ludovic | www.lachimie.net | tous droits r�serv�s | remis � jour le : 21/10/2020 |
|
|
|
Comment citer cette page : |
| Miseur, L. (2020). Lachimie.net - cours et ressources didactiques en chimie pour apprendre les savoirs disciplinaires, les savoir-faire et comp�tences de base des sciences chimiques. La Chimie.net. http://www.lachimie.net | |
|
|